摘要
患者源性异种移植物(PDX)是将患者的肿瘤组织植入免疫缺陷小鼠中构建的动物模型。这些模型准确地反映了不同癌症的生物学异质性,保留了肿瘤微环境,因此更接近病人的肿瘤特性,能够更好地预测患者的临床响应。目前,PDX已成为阐明肿瘤学新疗法和生物标志物的重要平台。本文综述了PDX模型的发展历史、构建过程及其在癌症治疗中的优势和应用。
肿瘤发生是一个动态的过程。在癌症进展过程中,遗传和表观遗传变异会导致患者之间产生不同的基因组景观,细胞异质性、耐药性和分化程度的差异增加了癌症的复杂性,这些特点导致单个患者体内癌症细胞差异化的表型和状态。因此,各种动物模型,如基因编辑小鼠模型(GEM)、患者衍生的类器官(PDO)和患者源性异种移植物(PDX),已被应用于癌症生物学研究。
作为癌症研究中应用最广泛的动物模型之一,PDX模型的建立始于患者手术或活检期间采集的原发肿瘤或转移瘤样本。这些样本在手术后立即被移植到免疫缺陷小鼠体内如裸鼠或重度免疫缺陷鼠并在宿主体内发展成为所谓的PDX。这种模型模拟了人类患者的肿瘤进展和演变,能够更真实地反映患者的肿瘤特征和临床响应,因此在癌症生物学研究和药物开发方面具有重要意义。
PDX模型的历史
人类对动物模型的研究最早可以追溯到古希腊“动物学之父”亚里士多德。他编写的《动物志》系统地描述了数百种动物的行为、解剖结构和生活习性。尽管亚里士多德的动物研究主要是为了探讨生物多样性,而并非为了特定的医学或药物研究,但他的工作对后来的科学研究有着深远的影响。
近代科学家为了将人类肿瘤移植到动物体内做出了很多尝试,但由于免疫系统对移植物的排斥,PDX模型能真正发展起来的首次突破是源于1962年的裸鼠的诞生;而第一个符合PDX模型定义的患者来源异种移植物可以追溯到1969年,丹麦学者Rygaard首次成功将人类结肠癌肿瘤移植到裸鼠体内[1]。此后,科学家们在裸鼠体内建立了各种PDX肿瘤模型,但PDX模型并未成为当时的主流,在1972年CDX(Cell Derived Xenograft)模型诞生后,由于其可获得性高、成本低等优势使得其取代PDX模型成为肿瘤模型的首选。直到2001年,Johnson等人报道了细胞系衍生模型与临床试验之间的药物反应一致性仍然差强人意[2]。
CDX只代表了在固定的基因组背景下具有特定基因畸变的癌症,且缺乏肿瘤异质性,无法概括肿瘤结构,因此很少能代表患者的真实反应。相比之下,PDX模型在反映癌症特征和模拟人类患者肿瘤的进展和进化方面表现出色。在临床前研究中,PDX模型产生了最令人信服的结果,被认为是最有希望解决困扰临床医生难题的模型之一,比如识别预后生物标志物、探索肿瘤内异质性对肿瘤进展的影响,以及评估新药等[3]。
PDX模型的构建
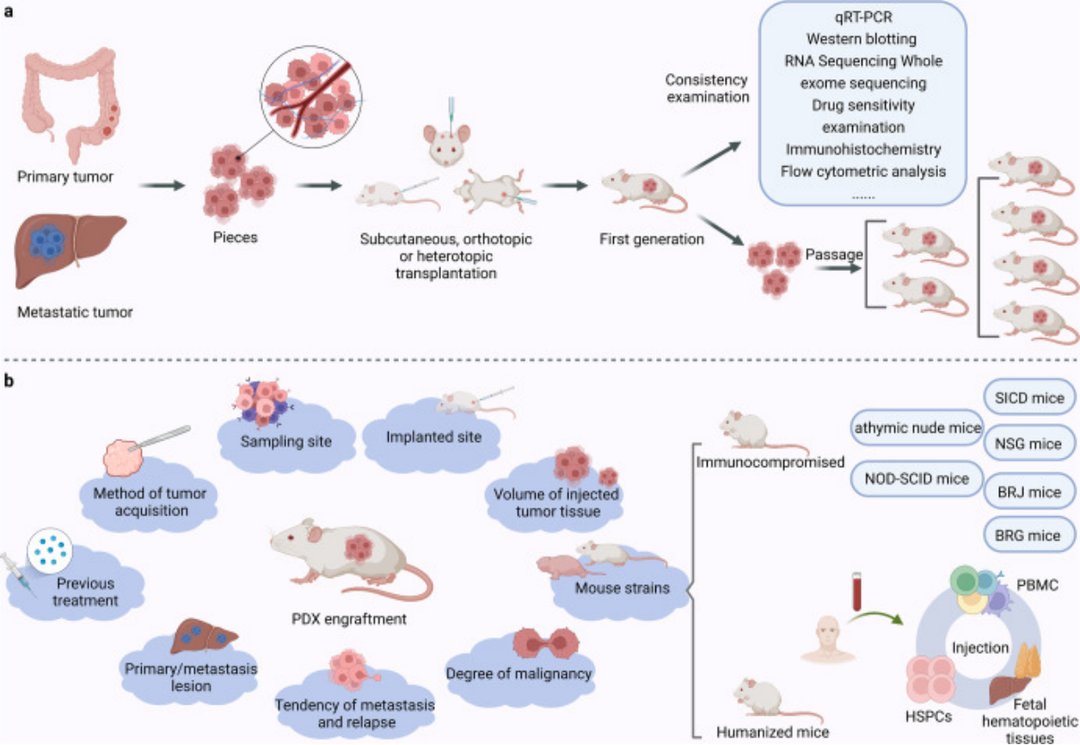
Fig.1 PDX模型的构建[4]
常用PDX模型构建方法是:
患者样本采集:PDX模型的建立始于患者手术或活检期间采集的原发性或转移性肿瘤,要确保采集到新鲜、高质量的组织,一般使用手术切除的原发肿瘤样本。
移植到实验动物:为了避免小鼠模型中的肿瘤植入排斥反应,通常使用免疫功能低下的小鼠创建常规PDX模型,本公司选用的是百奥赛图自主开发的B-NDG®小鼠(NOD.CB17-PrkdcscidIl2rgtm1/Bcgen)。B-NDG®小鼠是NOD-scid遗传背景的Il2rg基因敲除小鼠,缺乏成熟的T、B和NK细胞,是目前国际公认的免疫缺陷程度高、非常适合人源细胞或组织移植的工具小鼠。常用的移植方式有皮下移植和异种移植。移植过程中确保无菌、准确和高效。
移植后的观察:移植后,密切监测肿瘤的生长和发展情况,定期测量肿瘤体积。肿瘤生长周期一般为1至6个月,不同的肿瘤类型建立PDX模型的周期也有差别。待肿瘤大小生长至800-1200mm3,肿瘤组织被切除并切割成小块进行传代维持。
数据收集:目前百奥动物已成功构建248个PDX模型,其中包括9种癌种。在模型构建过程中,我们会保留冻存、病理、速冻样品,并收集整合病患信息、肿瘤生长曲线、模型树、HE、TMA、IHC、STR、蛋白突变、RNA测序等信息进行进一步分析。
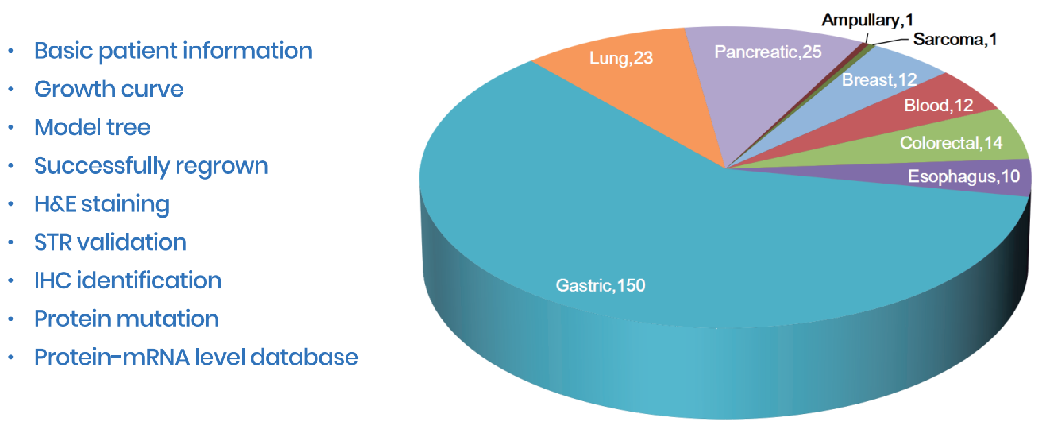
Fig.2 百奥赛图可提供的PDX模型
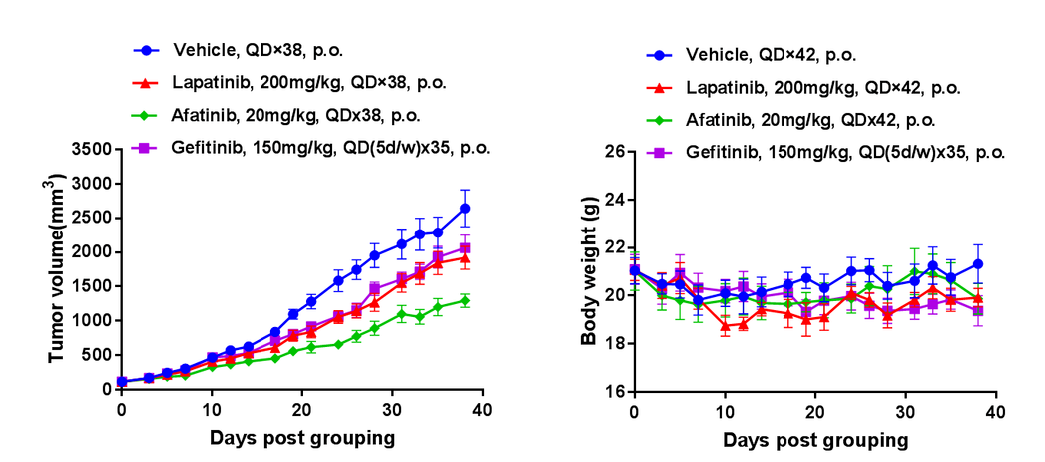
Fig.3 PDX在小分子化疗上的应用
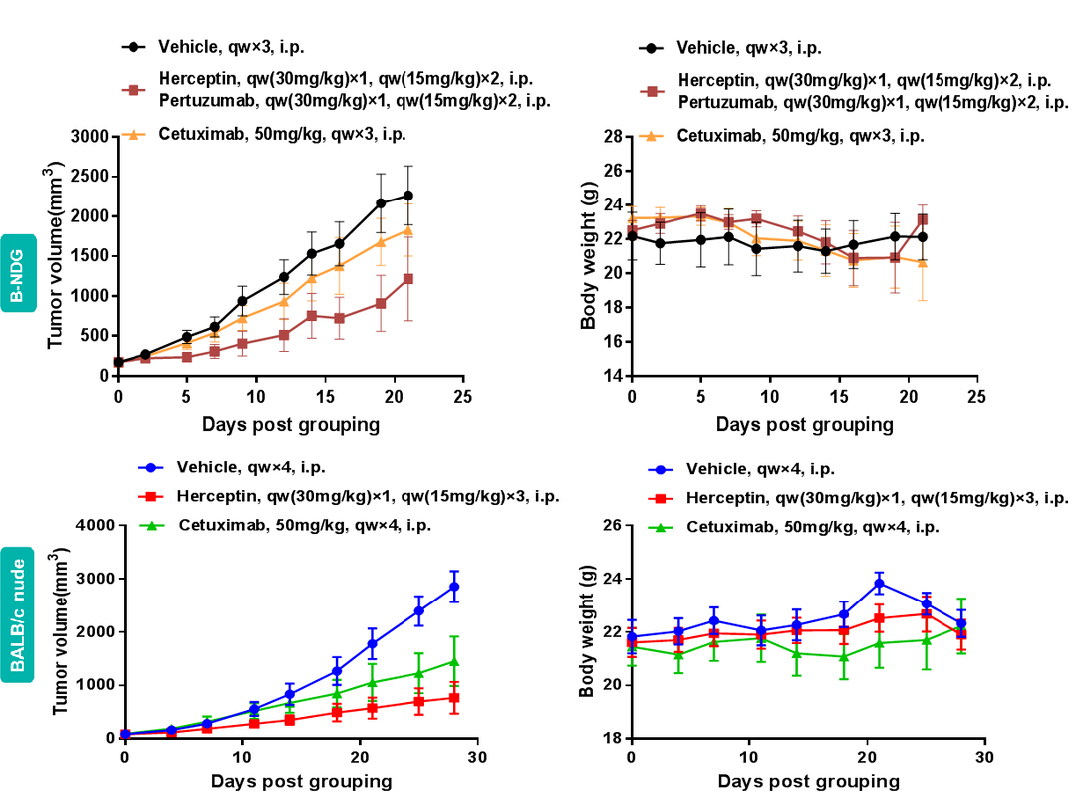
Fig.4 PDX在单抗上的应用
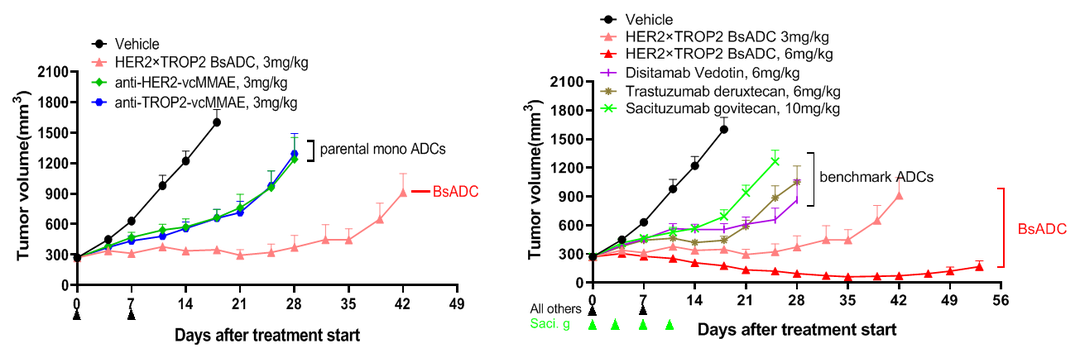
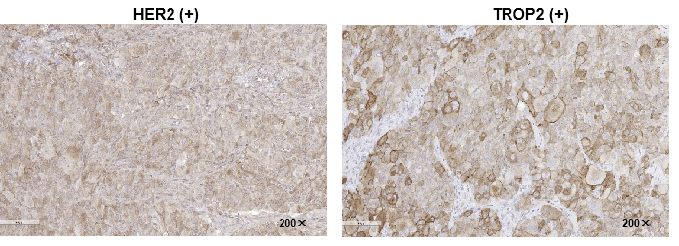
Fig.5 PDX在ADC上的应用
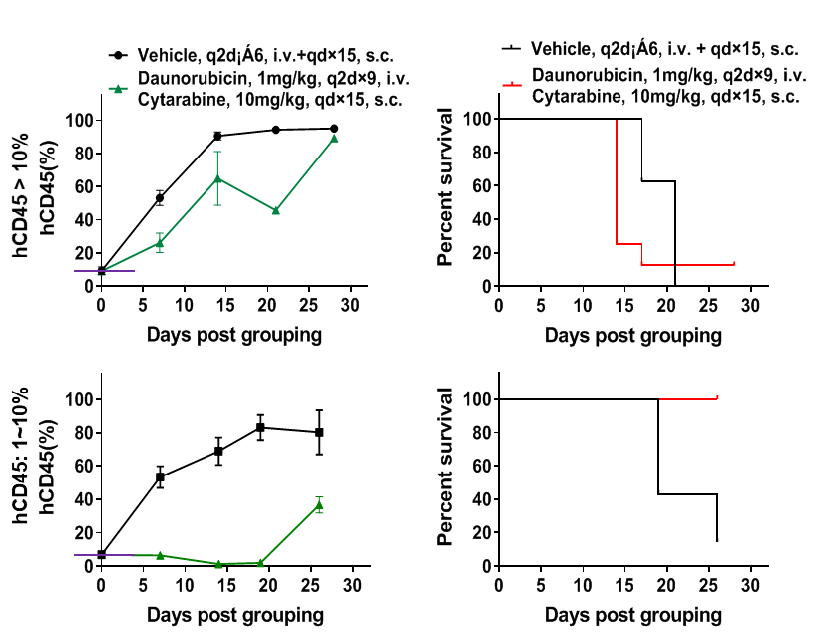
Fig.6 PDX在血液瘤上的应用
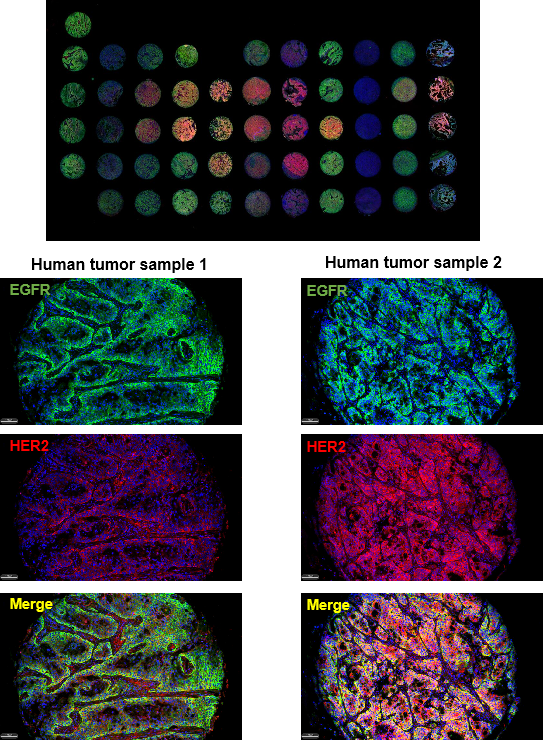
Fig.7 PDX-Biomarker服务
组织微阵列(Tissue Microarray,TMA)是将取自原始组织的多个组织样本以高密度数组的方式嵌入到一个单一的组织芯片中,可以同时检测和分析大量的组织样本,可以提供更全面和广泛的数据,减少了实验费用和试剂的使用量。百奥赛图已将现有PDX肿瘤组织制成TMA,结合IHC/TSA,进行靶点标志物筛选及共表达分析。
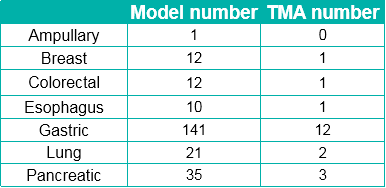
Fig.8 20 Tissue Microarray (TMA) for 232 PDX models
PDX模型的优势
在组织水平上,PDX保留了原发性患者肿瘤的特征,包括成纤维细胞、细胞外基质、淋巴细胞、巨噬细胞等,使其在模拟人体肿瘤组织生长、转移、血管生成、免疫抑制等方面具有独特优势,因此更能够反应肿瘤细胞及其微环境之间复杂的相互关系。
在细胞水平上,PDX模型准确得反映了人类肿瘤间和肿瘤内的异质性,以及原始癌症的表型和分子特征,包括基因表达模式、突变状态、拷贝数,以及DNA甲基化、蛋白质组学。这使得PDX模型更能够模拟人体内肿瘤的真实环境和响应。
PDX模型保留了不同阶段、亚型和多样化治疗背景的患者的基因组特征,遵循人类原发性肿瘤中发现的耐药途径与肿瘤微环境对药物的影响,相比CDX能更准确反映患者肿瘤的发生发展机制和药物敏感性、耐受性。
优化的PDX植入程序和现代技术(如多组学和深度学习)能够更全面地描述PDX分子景观,并提高PDX模型的利用率。
这些不可替代的优势使PDX模型成为癌症治疗研究的理想选择,例如新药的临床前试验、新型药物组合的验证、药物敏感患者的筛选以及耐药机制的探索。
PDX模型在癌症研究中的应用
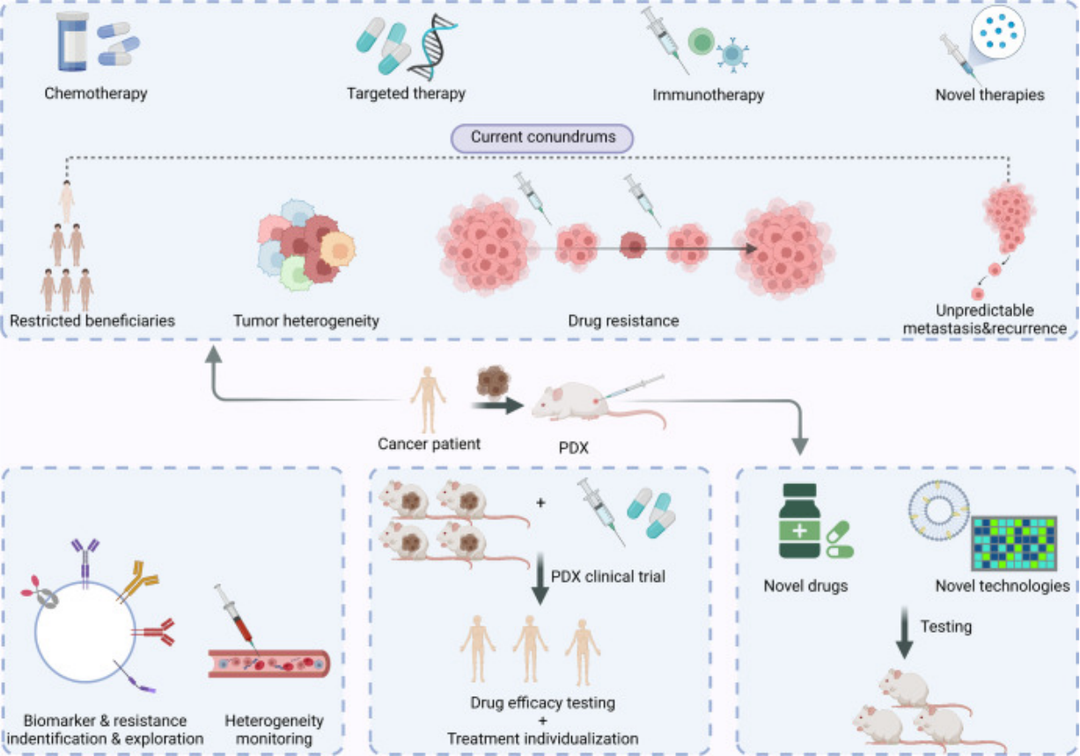
Fig.9 癌症治疗新时代的PDX[4]
PDX模型的应用示例:
临床关联性与预测价值:由于保留了患者肿瘤的特征,PDX模型被广泛应用于预测患者的临床响应和疗效。通过观察PDX模型对不同治疗方法的反应,研究人员可以评估疗效,并将该信息应用于指导患者的个性化治疗。
药物筛选和开发:PDX模型提供了一个实验平台,用于评估不同化疗药物、靶向药物和免疫疗法对患者肿瘤的疗效。其他应用还包括通过连续施用特定药物建立耐药PDX模型。这些耐药肿瘤比细胞系更符合癌细胞的特征,可用于耐药生物标志物的追踪和耐药机制研究[5],从而帮助加速新药物的研发和临床转化。
肿瘤生物学研究:使用PDX模型进行肿瘤生物学研究可以帮助揭示肿瘤的生长、转移、侵袭等基本生物学过程,深入了解癌症的发生机制,并为新的治疗策略的开发提供理论基础。
PDX在免疫治疗中的应用:将PDX植入人源免疫系统重建小鼠(PBMC或者CD34 HSC重建)体内,构建肿瘤与免疫双人源化模型,具有可重现人体内免疫细胞与肿瘤间相互作用的优势,成为生理和病理条件下更加模拟人体肿瘤免疫治疗疗效的新模型。
总而言之,PDX肿瘤模型是一种能够保留患者肿瘤特征的实验模型,通过模拟真实肿瘤的生长和响应,PDX模型有助于加速药物开发和优化治疗策略,广泛应用于药物筛选、个体化治疗和肿瘤生物学等方面,在癌症研究中扮演着重要角色。
参考文献
[1] Rygaard, J. & Povlsen, C. O. Heterotransplantation of a human malignant tumour
to “Nude” mice. Acta Pathol. Microbiol. Scand. 77, 758–760 (1969).
[2] Johnson, J. I. et al. Relationships between drug activity in NCI preclinical in vitro and in vivo models and early clinical trials. B r . J . C a n c e r 84, 1 4 2 4–1431(2001).
[3] Gao, H. et al. High-throughput screening using patient-derived tumor xenografts to predict clinical trial drug response. Nat. Med. 21, 1318–1325 (2015).
[4] Liu Y, Wu W, Cai C, Zhang H, Shen H, Han Y. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 2023 Apr 12;8(1):160. doi: 10.1038/s41392-023-01419-2IF: 39.3 Q1 . PMID: 37045827; PMCID: PMC10097874.
[5]Das Thakur M, Salangsang F, Landman AS, Sellers WR, Pryer NK, Levesque MP, Dummer R, McMahon M, Stuart DD. Modelling vemurafenib resistance in melanoma reveals a strategy to forestall drug resistance. Nature. 2013 Feb 14;494(7436):251-5. doi: 10.1038/nature11814. Epub 2013 Jan 9. PMID: 23302800; PMCID: PMC3930354.












 京公网安备:
京公网安备: