哮喘(Asthma)是一种慢性气道炎症性疾病,具有可变气流阻塞、气道高反应性(AHR)和气道炎症等特征。哮喘的主要临床症状是呼吸短促、气喘、咳嗽以及接触过敏原后粘液分泌增多。其发病是由遗传、表观遗传和环境因素之间的复杂相互作用引起的。不同的病理改变由气道上皮细胞、嗜酸性粒细胞和T淋巴细胞亚群等多种参与免疫应答的细胞介导,其中Th2细胞被认为在高嗜酸性粒细胞型哮喘中占主导地位,伴随细胞因子IL-4、IL-5和IL-13水平升高。经典的小鼠哮喘模型是卵清蛋白(OVA)诱导的气道炎症模型,小鼠经多次腹腔注射OVA致敏,雾化吸入OVA后激发,建立急性哮喘模型。其血清IgE和肺泡灌洗液中的嗜酸性粒细胞水平升高,病理组织切片染色显示:气道粘液及炎症性白细胞浸润增多1, 2。
百奥赛图提供了一个有效的OVA诱导的小鼠哮喘模型,并且在不同品系(C57BL/6,B-hIL4/IL4RA mice,B-hIL33 mice)中进行了验证,可用于哮喘治疗药物的药效评价。
OVA诱导的急性哮喘模型
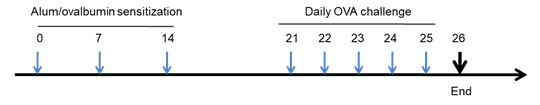

致敏阶段:在第0天、7天、14天,腹腔注射OVA+Al(OH)3;
激发阶段:在21-25天,每天使用2%的OVA雾化小鼠30min。
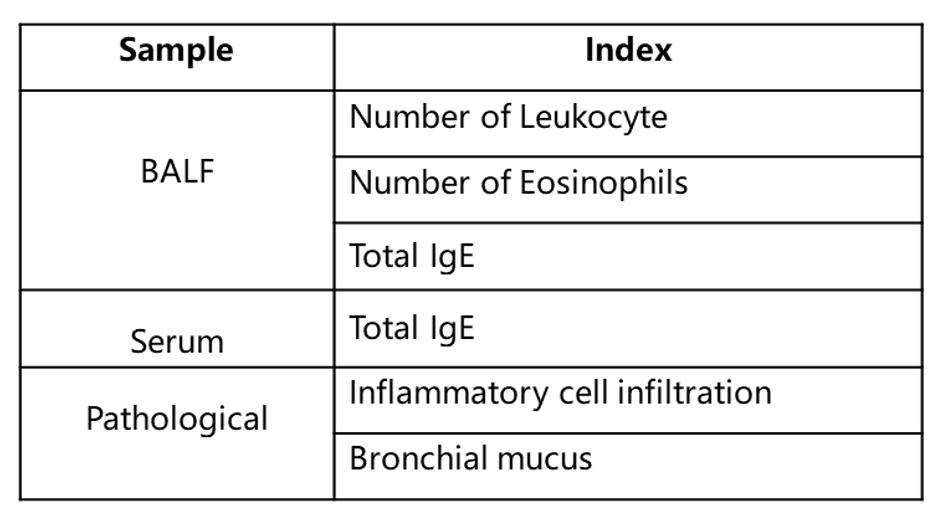
哮喘小鼠模型肺泡灌洗液(BALF)中免疫细胞的数量

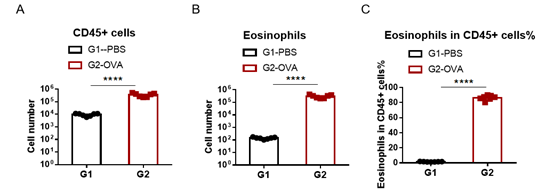
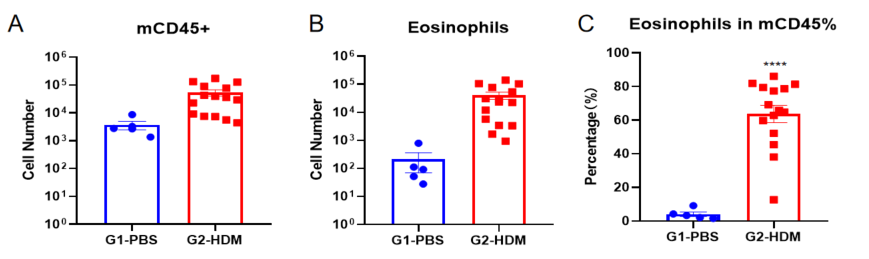
使用OVA在野生型C57BL/6小鼠中诱导哮喘模型。(A)BALF 中CD45+细胞的数量;(B)BALF 中嗜酸性粒细胞的数量;(C)嗜酸性粒细胞占CD45+细胞的比例。结果显示:经OVA致敏和激发后,G2造模组小鼠的白细胞数量与G1未造模组相比显著增加,其中嗜酸性粒细胞数量及比例都有显著增加。
哮喘小鼠模型血清中IgE水平
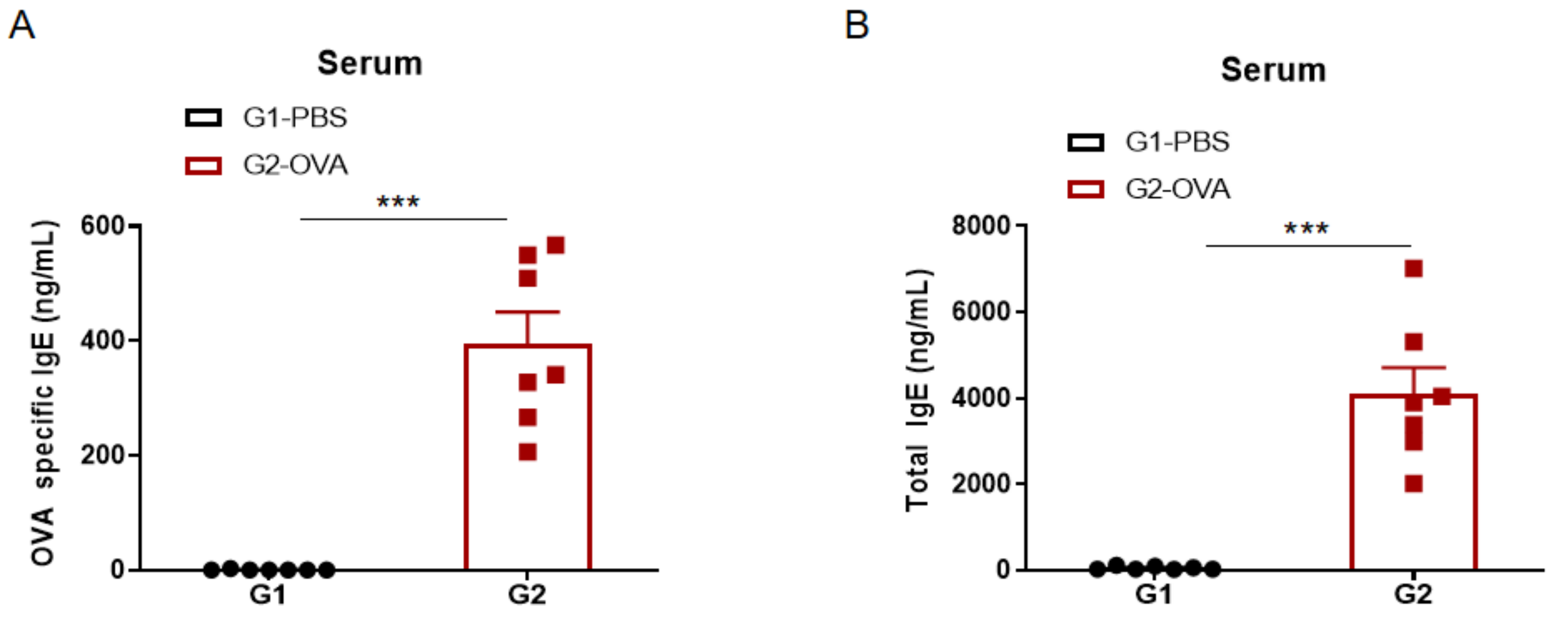

哮喘小鼠模型血清中IgE水平的检测。实验终点取血清,使用ELISA检测OVA特异性的IgE和血清总IgE的浓度。(A)血清中OVA 特异性IgE的浓度。(B)血清中总IgE的浓度。结果显示:G2造模组与G1未造模组相比血清中OVA特异性IgE和总IgE的浓度显著性升高。
哮喘小鼠模型H&E染色病理分析

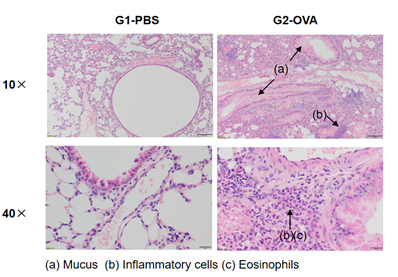
哮喘小鼠模型肺部H&E染色分析。结果显示:与G1未造模组相比,G2造模组动物肺脏镜下均表现出血管及支气管周围混合炎细胞浸润(b)和部分支气管中黏液(a)形成的哮喘相关病理性改变。以上结果证明OVA能成功诱导野生型C57BL/6小鼠建立哮喘模型。
OVA诱导的急性哮喘模型

使用野生型BALB/c小鼠构建哮喘模型,在第0天、7天、14天,腹腔注射OVA和Al(OH)3致敏小鼠;21-25天雾化吸入卵清蛋白后激发,20-25天腹腔注射地塞米松,共给药6次。
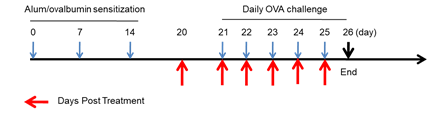
哮喘小鼠模型肺泡灌洗液(BALF)中免疫细胞的数量

使用OVA在野生型BALB/c小鼠中诱导哮喘模型。(A)BALF 中CD45+细胞的数量;(B)BALF 中嗜酸性粒细胞的数量;(C)嗜酸性粒细胞占CD45+细胞的比例。结果显示:经OVA致敏和激发后,G2造模组小鼠的白细胞数量与G1未造模组相比显著增加,其嗜酸性粒细胞的数量与比例都有显著增加,提示造模成功。给予不同浓度的地塞米松(Dex)后,其CD45阳性细胞和嗜酸性粒细胞与G2造模组相比显著性降低。
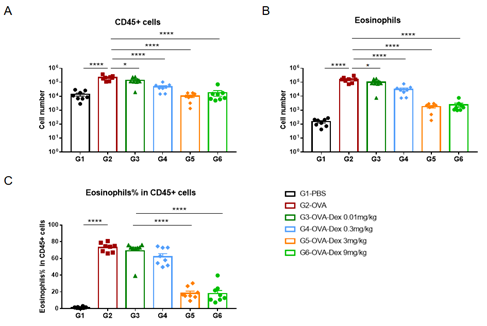
哮喘小鼠模型血清中的IgE水平
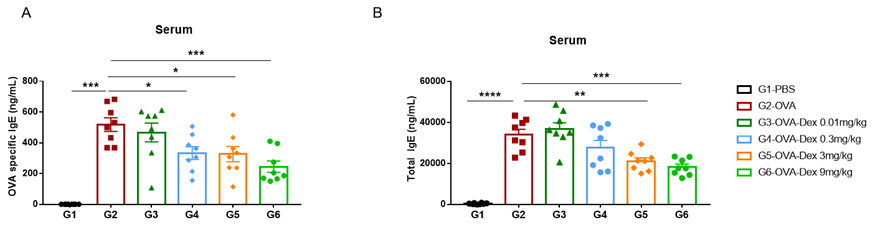

哮喘小鼠模型血清中IgE水平的检测。实验终点取血清,使用ELISA检测OVA特异性IgE和总IgE的浓度。(A)血清中OVA 特异性IgE的浓度。(B)血清中总IgE的浓度。结果显示:G2造模组与G1未造模组相比血清中OVA特异性IgE和总IgE水平显著性增加,提示造模成功。给予不同浓度地塞米松(Dex)后其特异性IgE和总IgE水平与G2造模组相比显著性降低,且缓解程度呈现一定的剂量依赖性。
H&E染色病理分析

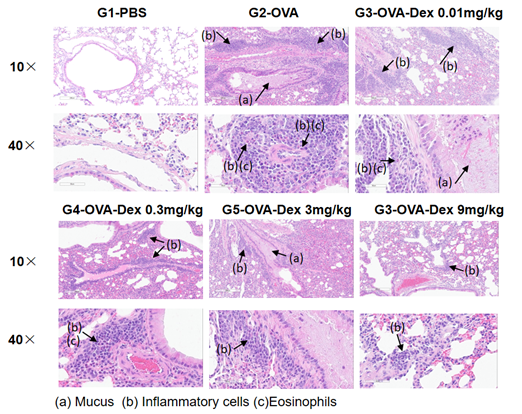
哮喘小鼠模型肺部H&E染色分析。结果显示G1未造模组肺部气道未见炎症反应。G2造模组的血管及支气管周围炎症显著增加,粘液分泌水平增加,提示造模成功。G3-G6给药组给予不同浓度地塞米松后,小鼠炎症浸润和黏液分泌减少。以上结果证明OVA诱导的小鼠哮喘模型能成功用于验证皮质类固醇类免疫抑制剂的药效。
0VA诱导的急性哮喘模型
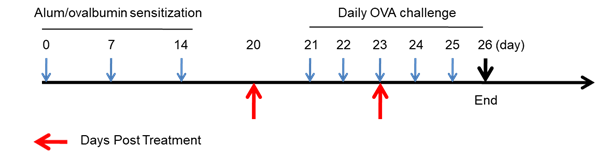

使用B-hIL4/hIL4RA小鼠构建哮喘模型,在第0天、7天、14天,腹腔注射OVA和Al(OH)3致敏小鼠;21-25天雾化吸入OVA后激发,在第20和23天腹腔注射IL4RA 抗体药物dupilumab(内部合成)。
哮喘小鼠模型肺泡灌洗液(BALF)中免疫细胞的数量
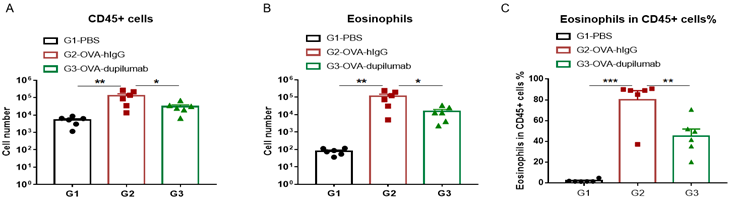

使用OVA在B-hIL4/hIL4RA小鼠中诱导哮喘模型。(A)BALF 中CD45+细胞的数量。(B)BALF 中嗜酸性粒细胞的数量。(C)嗜酸性粒细胞占CD45+细胞的比例。结果显示:经OVA致敏和激发后,G2造模组小鼠的白细胞浸润与G1未造模组相比显著增加,其嗜酸性粒细胞含量显著增加,提示造模成功。给予dupilumab (内部合成) 后,其CD45+细胞和嗜酸性粒细胞的数量与G2造模组相比显著降低。
哮喘小鼠模型血清中IgE水平

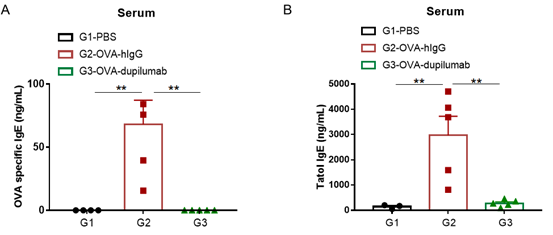
哮喘小鼠模型血清中IgE水平的检测.实验终点取血清,使用ELISA检测OVA特异性IgE和总IgE水平。(A)血清中OVA 特异性IgE水平。(B)血清中总IgE水平。结果显示:G2造模组与G1未造模组相比OVA特异性IgE和总IgE水平显著增加,提示造模成功。给予dupilumab (内部合成) 药物后其特异性IgE和总IgE水平与G2造模组相比显著性降低。
H&E染色病理分析
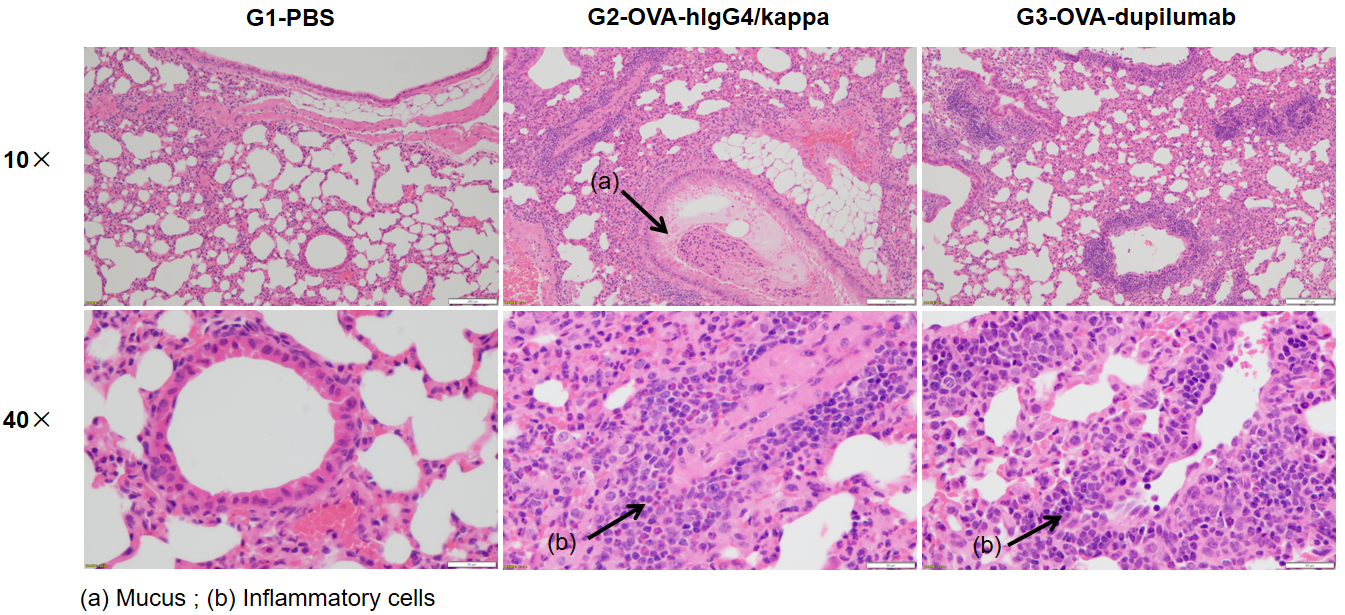

哮喘小鼠模型肺部H&E染色分析。结果显示G1未造模组肺部气道未见炎症反应。G2造模组的血管及支气管周围炎症(b)显著增加,粘液(a)分泌水平增加,提示造模成功。G3给药组显示经dupilumab(内部合成)治疗的小鼠炎症浸润和粘液分泌减少。以上结果证明OVA能成功在B-hIL4/hIL4RA小鼠中建立哮喘模型用于药效评价。
实验动物:C57BL/6, BALB/c, 5-6周龄,雌性
建模试剂:50μg HDM in 50μl PBS (intranasally, i.n.)
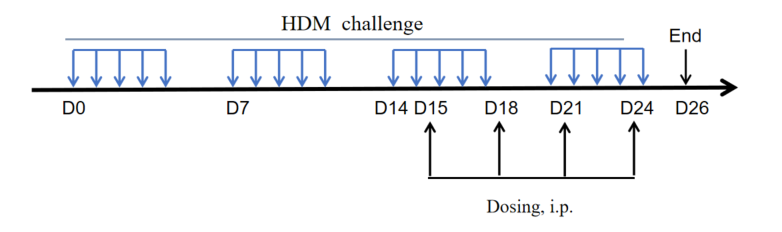
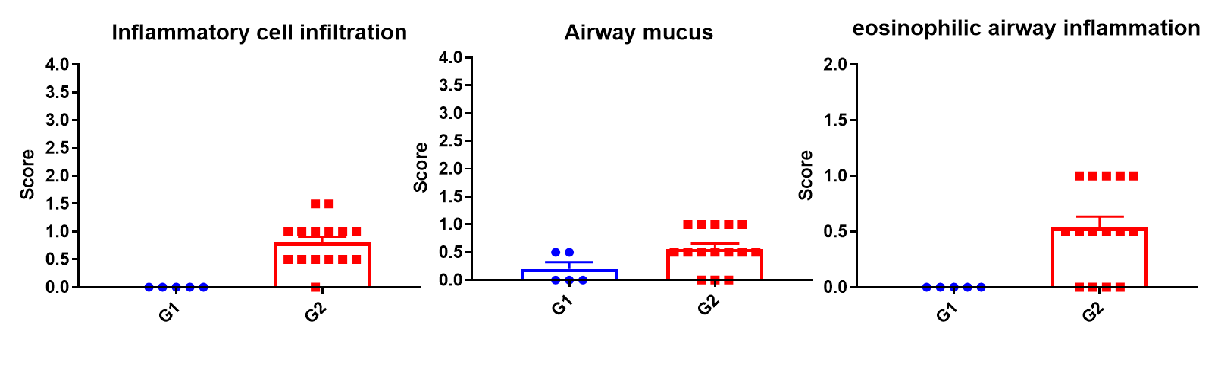
Criteria of Asthma Mouse Model Establishment
哮喘小鼠模型肺泡灌洗液(BALF)中免疫细胞的数量
哮喘小鼠模型血清中IgE水平
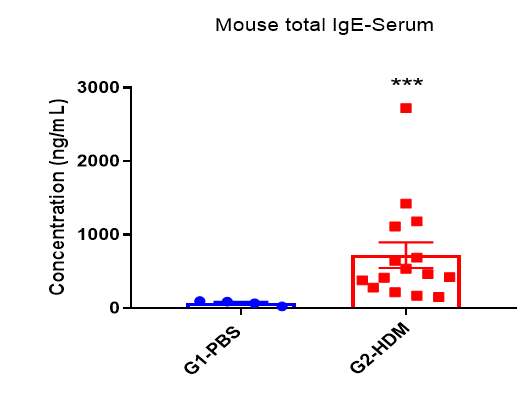
与对照组相比,HDM诱导的小鼠血清中IgE水平升高。实验终点取血清,ELISA法测定总IgE浓度。
H&E染色病理分析
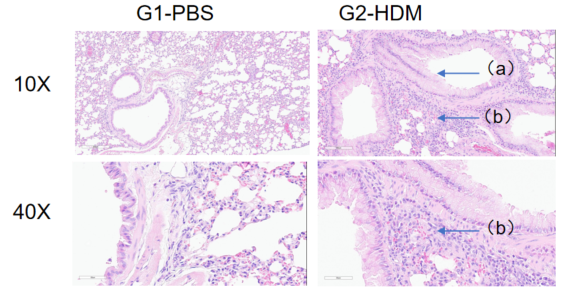
哮喘小鼠肺部H&E染色分析。与G1组相比,HDM处理后的G2模型动物出现哮喘相关病变,部分支气管血管和支气管周围混合炎性细胞浸润(b)、黏液形成(a)。以上结果表明,HDM可成功诱导野生型C57BL/6小鼠哮喘。
Dupilumab(抗人IL4RA抗体药物)在人源化B-hIL4/hIL4RA哮喘小鼠中的药效评估
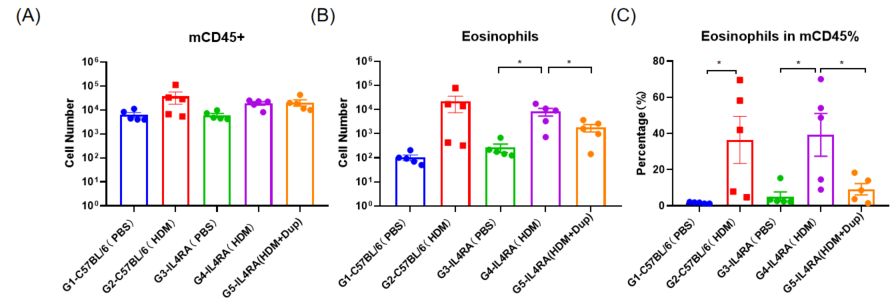
采用HDM法建立B-hIL4/hIL4RA小鼠哮喘模型。(A) BALF中CD45 +细胞的数量。(B) BALF中嗜酸性粒细胞的数量。(C)嗜酸性粒细胞占CD45 +细胞的比例。结果显示,经HDM致敏和激发后,G4模型组小鼠白细胞浸润较G3对照组明显增加,嗜酸性粒细胞含量明显增加,提示模型建立成功。给药25mg/kg dupilumab(内部合成)后,CD45 +细胞和嗜酸性粒细胞数量明显低于G3模型组。
哮喘小鼠模型血清中IgE水平
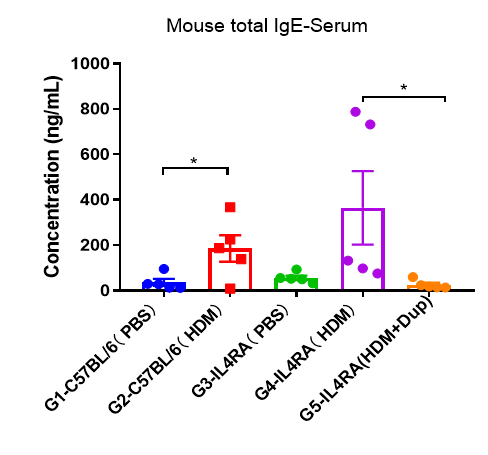
哮喘小鼠血清中IgE水平的检测。实验终点取血清,采用ELISA法测定血清总IgE水平。结果显示,与G3对照组相比,G4模型组大鼠总IgE水平明显升高,表明造模成功。与G5模型组相比,给药dupilumab(内部合成)后总IgE水平显著降低。
参考文献
1. Gandhi, N.A. et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov 15, 35-50 (2016).
2. Audrey Le Floc’h, N.A. et al. Dual blockade of IL-4 and IL-13 with dupilumab, an IL-4Rα antibody, is required to broadly inhibit type 2 inflammation. Allergy, 75(5), 1188-1204(2020)
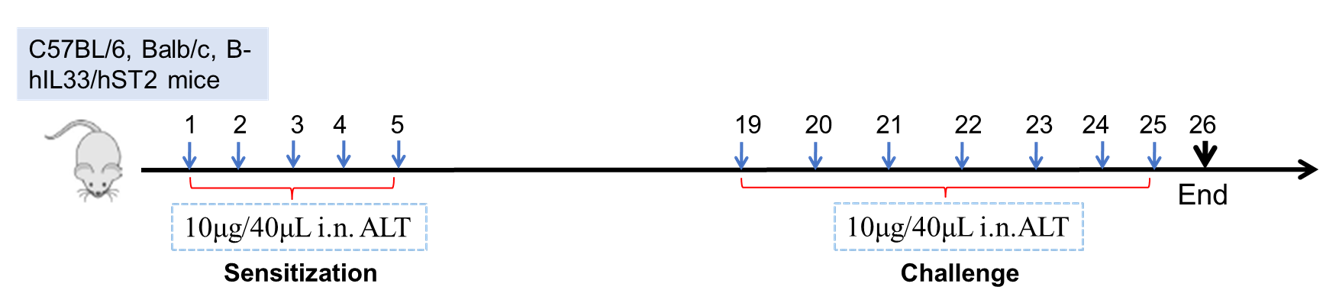
Establishment of Asthma Mouse Model
Establishment of Asthma Mouse Model: ALT-induced asthma model
Experimental Animals:C57BL/6, Balb/c, B-hIL33/hST2 mice
Modeling reagent:ALT (Alternaria )
Modeling method:Sensitization—1-5 days
Challenge—19-26days
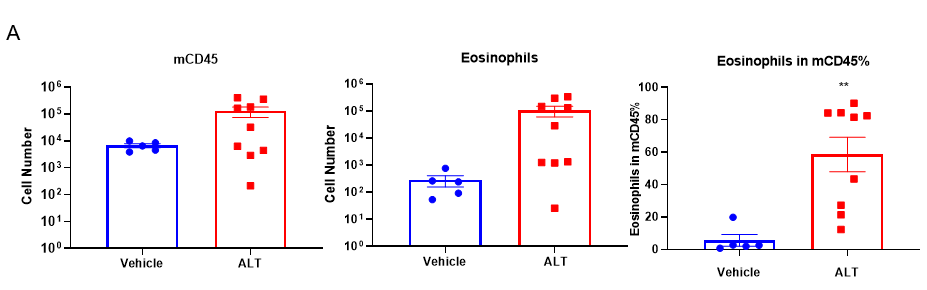
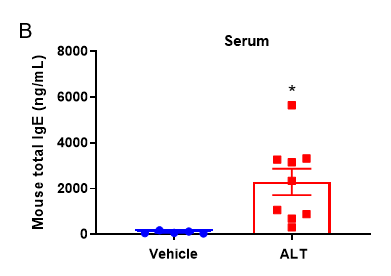
Quantification of Immune Cells in BALF and total IgE levels in serum of ALT-induced Asthmatic mouse model based on C57BL/6 mice.
(A) number of CD45+ cells, eosinophils and frequency of eosinophils in the CD45+ cell population after sensitization and challenge with ALT. (B) Serum was taken at the experimental endpoint and concentrations of total IgE were measured using ELISA. Values are expressed as mean ± SEM. *p<0.05, **p<0.01.
Histologic Assessment of the lungs of asthmatic mouse model
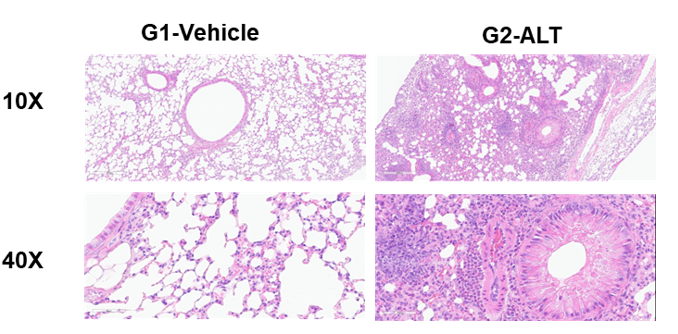
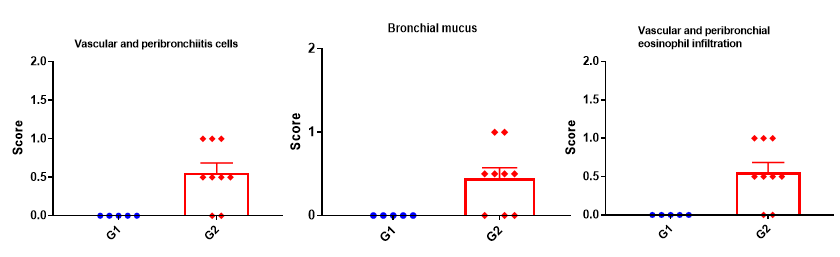
H&E staining in the lungs of asthmatic mice. ALT-induced asthma model animals showed asthma-related pathological changes as demonstrated by vascular and peribronchial mixed inflammatory cell infiltration and mucus formation in some bronchi. The score of cells and infiltration of vascular and peribronchial eosinophil were increased after ALT treatment.

参考文献
1. Michael C Yee. Et al. Protease-activated receptor-2 signaling through β-arrestin-2 mediates Alternaria alkaline serine protease- induced airway inflammation. Am J Physiol Lung Cell Mol Physiol. 315(6):L1042-L1057 (2018).
2. Robert J Snelgrove. et al. Alternaria-derived serine protease activity drives IL-33-mediated asthma exacerbations. J Allergy Clin Immunol. 134(3):583-592.e6 (2014).
3. Gandhi, N.A. et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov 15, 35-50 (2016).
4. Pelaia, G., Vatrella, A. & Maselli, R. The potential of biologics for the treatment of asthma. Nat Rev Drug Discov 11, 958-972 (2012).
|
产品名称 |
产品编号 |
|
B-hIL4/hIL4RA mice |
120551 |
|
B-hIL33 mice |
110055 |
|
B-hIL13 mice |
110058 |
参考文献:
1. Gandhi, N.A. et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov 15, 35-50 (2016).
2. Pelaia, G., Vatrella, A. & Maselli, R. The potential of biologics for the treatment of asthma. Nat Rev Drug Discov 11, 958-972 (2012).












 京公网安备:
京公网安备: