AD小鼠模型介绍
特应性皮炎(Atopic dermatitis,AD)是一种慢性皮肤病,表现为瘙痒、红斑和鳞状皮损,伴发心血管疾病、精神障碍(抑郁、焦虑、睡眠障碍等)等疾病。为了更好地研究特应性皮炎,研究人员在小鼠上开发了多种特应性皮炎动物模型,包括(1)利用上皮敏感抗原、半抗原等增强皮肤致敏引起的AD模型;(2)基因工程小鼠AD模型;(3)自发性AD小鼠模型。
百奥赛图使用野生型C57BL/6小鼠和B-hIL4/hIL4RA双人源化小鼠实验性诱导皮炎。采用恶唑酮(OXA)致敏和持续激发化学诱导病变,建立AD疾病模型,用于AD相关药物的药效评价。
AD小鼠模型的构建
实验动物:C57BL/6, BALB/c,5-6周龄,雌性
造模试剂:OXA
造模方法:致敏—Day0涂抹右耳+背部
激发—Day7~Day25涂抹右耳+背部
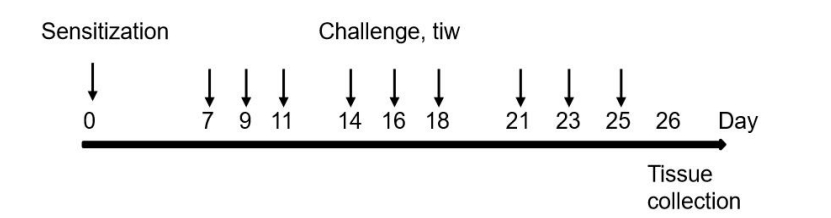
临床评分
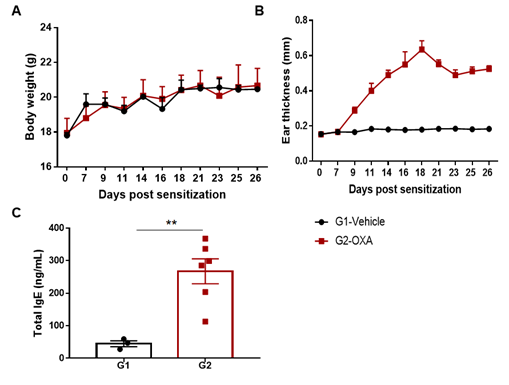
用OXA诱导野生型C57BL/6小鼠AD模型。(A)小鼠体重。(B)耳厚度。(C)血清总IgE浓度。OXA治疗组耳厚度和血清IgE明显升高。
组织病理分析
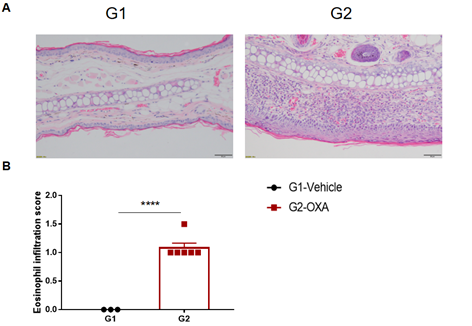
野生型C57BL/6 AD模型的耳部皮肤病理学和淋巴细胞浸润分析。(A)小鼠耳组织切片的苏木精和伊红(H&E)染色;(B)耳表皮的嗜酸性粒细胞浸润评分。OXA治疗组表皮出现不同程度的基质细胞增生、增厚、角化过度伴角化不足、痂皮、真皮及皮下组织混合性炎性细胞浸润等特应性皮炎相关病理改变。嗜酸性粒细胞的浸润评分明显增高。上述结果证明OXA能成功诱导野生型C57BL/6小鼠AD样病理。
AD小鼠疾病模型用于关节炎药物药效评价的实例
AD小鼠疾病模型(C57BL/6)用于评价Dexamethasone药效
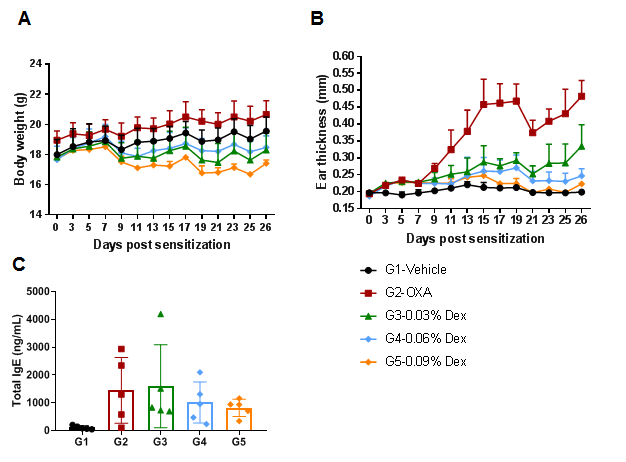
在野生型C57BL/6 AD模型中验证了地塞米松(Dex)的有效性。(A)小鼠体重。(B)耳厚度。结果表明,与单纯OXA组相比,不同浓度的地塞米松均能显著降低耳厚度。高剂量组(0.09%Dex)可完全缓解耳部皮肤水肿至与对照组相同的水平。但与对照组相比也伴有明显的体重减轻。(C)血清总IgE浓度。结果表明,G4中剂量组(0.06%Dex)和G5高剂量组(0.09%Dex)地塞米松可降低血清总IgE浓度。
AD样疾病病理分析
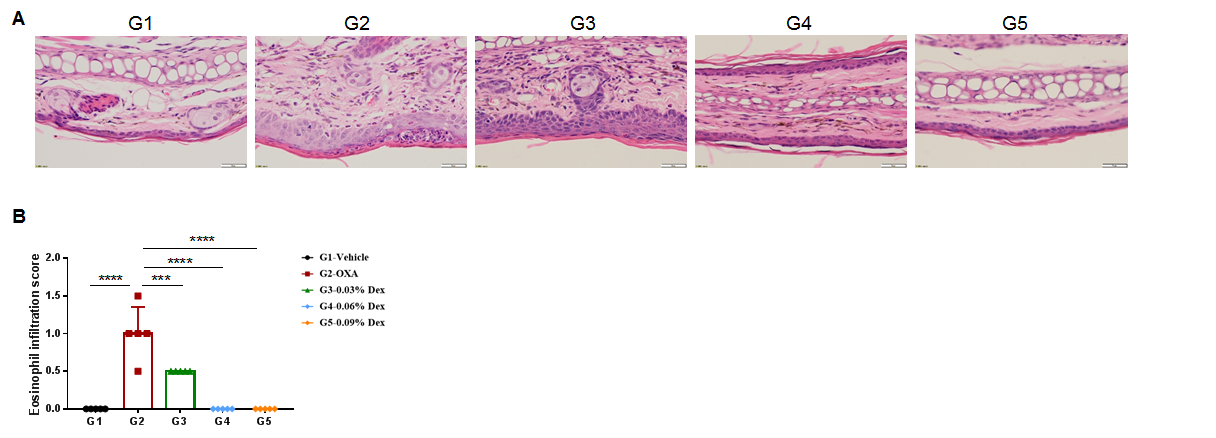
使用野生型AD模型验证地塞米松的疗效。(A)小鼠耳组织切片的苏木精和伊红(H&E)染色。(B)耳表皮嗜酸性粒细胞浸润评分。结果表明,OXA治疗组(G2)动物耳部皮肤表皮可见基质细胞增生、增厚、混合性炎性细胞浸润等与异位性皮炎有关的病理变化,并且与G2造模组相比,Dex治疗组(G3-G5)这些表型明显减轻,尤其是高剂量组(0.09%Dex),恢复到基线。G3-G5组皮肤嗜酸性粒细胞浸润评分明显低于G2组。总体而言,地塞米松可改善特应性皮炎相关症状,0.06%和0.09%浓度的Dex可改善疗效。上述结果表明,利用OXA可成功诱导AD小鼠模型进行疗效评价。
B-hIL4/hIL4RA小鼠中抗人IL4RA抗体Dupilumab(内部)的有效性评价
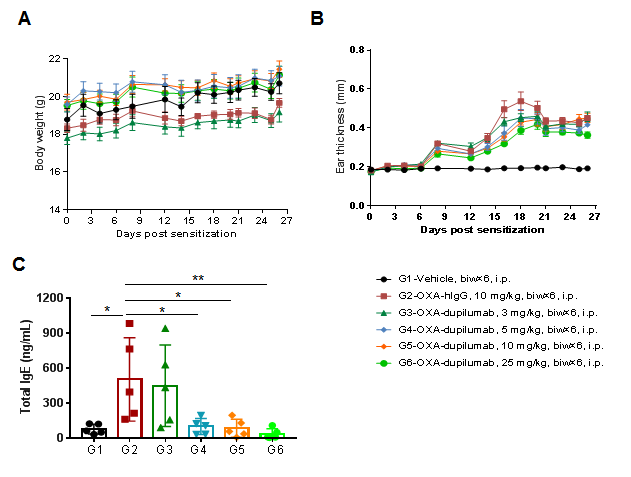
使用人源化B-hIL4/hIL4RA小鼠中生成的AD模型验证抗人IL4RA抗体dupilumab(内部合成)的疗效。(A)小鼠体重。(B)耳厚度。结果显示,与G2(OXA + IgG)组相比,不同浓度的dupilumab可以改善耳部皮肤水肿。(C)血清中总IgE浓度。较高浓度的dupilumab显著降低了血清总IgE浓度。耳厚度和血清总IgE浓度与抗体剂量呈负相关。
B-hIL4/hIL4RA小鼠AD模型病理分析
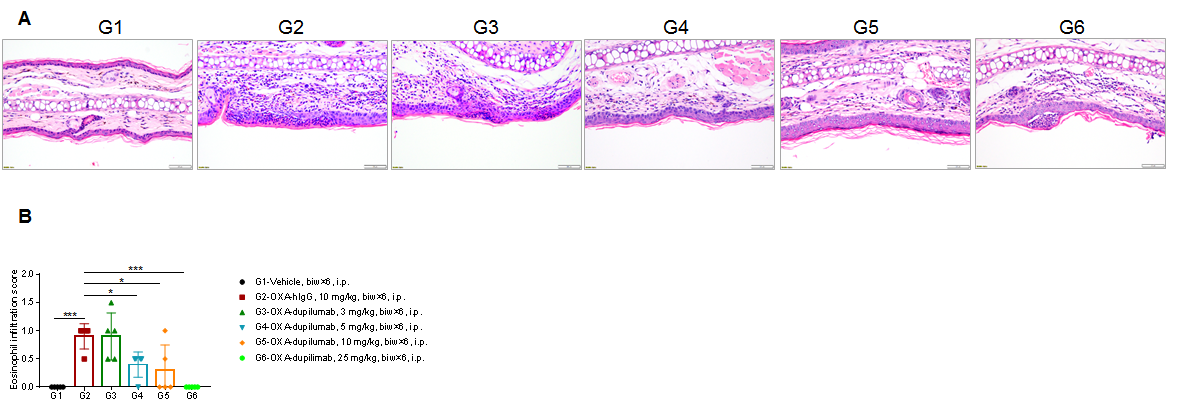
使用人源化B-hIL4/hIL4RA小鼠中生成的AD模型验证抗人IL4RA抗体dupilumab(内部合成)的疗效。(A)小鼠体重。(B)耳厚度。结果显示,与G2(OXA + IgG)组相比,不同浓度的dupilumab可以改善耳部皮肤水肿。(C)血清中总IgE浓度。较高浓度的dupilumab显著降低了血清总IgE浓度。耳厚度和血清总IgE浓度与抗体剂量呈负相关。
Product list
|
Product name |
Product number |
|
B-hIL4/hIL4RA mice |
120551 |
References
1. Vatrella, A., Fabozzi, I., Calabrese, C., Maselli, R. & Pelaia, G. Dupilumab: a novel treatment for asthma. J Asthma Allergy 7, 123-130 (2014).
2. Gandhi, N.A. et al. Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov 15, 35-50 (2016).












 京公网安备:
京公网安备: