您可能也喜欢
在刚刚落幕的第85届美国糖尿病协会(ADA)年会上,一项引人注目的临床研究成果引爆了医学界与产业界对“减脂增肌”新路径的关注。礼来在大会上公布了Bimagrumab IIb期BELIEVE研究的结果,不仅显著提高了体重和脂肪减少的比例,更实现了肌肉量的保留甚至增长,预示着新一代“精雕型”抗肥胖治疗模式的到来。
BELIEVE是一项IIb期、多中心、随机双盲安慰剂对照临床试验,共纳入507名超重或肥胖人群,评估Bimagrumab单药及与司美格鲁肽联合治疗对体重与体成分的影响:
Bimagrumab单药治疗患者的体重减少实现100%来源于脂肪,并且增加了2.5%的总瘦体重。
Bimagrumab与司美格鲁肽联合用药治疗患者平均体重下降22.1%,显著显著优于司美格鲁肽组(15.7%)和bimagrumab组(10.8%)。
Bimagrumab与司美格鲁肽联合用药治疗患者92.8%的体重减少来自脂肪组织,远高于司美格鲁肽单药的71.8%。
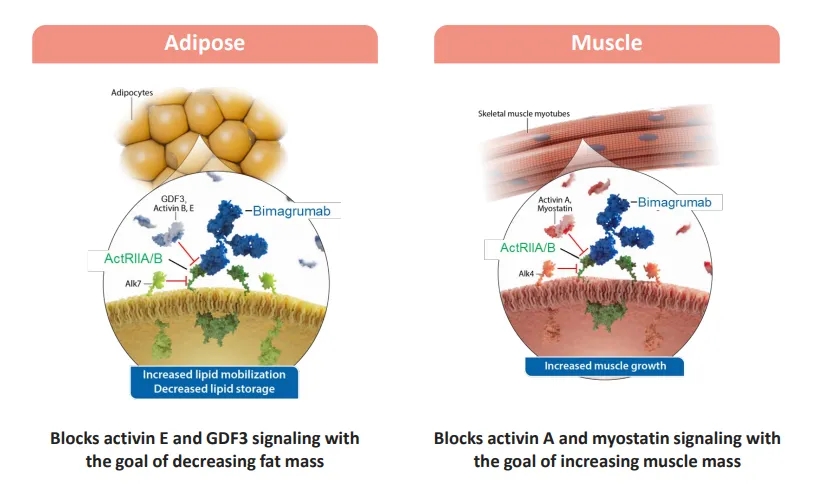
图1.Bimagrumab作用机制(来源:Lilly ADA investor event deck)
减脂增肌“双优”目标,推动热门靶点和组合疗法研究
在GLP-1类药物掀起的“瘦身革命”背后,一个不可忽视的问题也逐渐浮出水面:患者体重下降中约有15-40%是肌肉流失。这不仅可能削弱基础代谢率,增加体重反弹风险,也与老年人群的衰弱和骨骼健康问题相关。为此,业界已将目光投向“减脂+增肌”双重疗效的解决方案。当前研究热门路径主要集中在以下两个方向:
靶向Myostatin/Activin-A通路,“减脂+增肌”双击靶点
Activin type II受体(ActRIIA和ActRIIB)是TGF-β家族成员如Activin与Myostatin(肌生成抑制素,也叫GDF8)信号传导的关键节点。这些配体首先结合ActRII,引发与Type I受体(如ALK4、ALK5)的复合体形成,进而磷酸化Smad2/3信号分子,调控肌肉生长、纤维化、炎症等生理过程。Myostatin主要通过ActRIIB抑制骨骼肌增殖,因此拮抗ActRII信号被视为“减脂增肌”治疗的重要靶点。
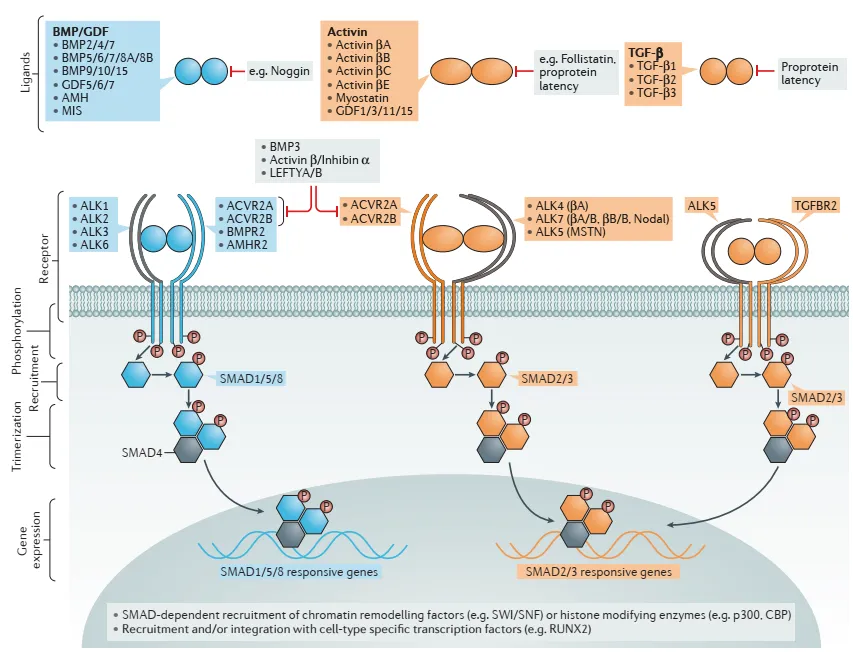
图2.骨形态蛋白BMP超家族经典信号通路的基本机制[2]
燃爆ADA大会的Bimagrumab就是一款靶向ActRII的全人单抗,可抑制Myostatin和Activin-A信号,促进肌肉合成、抑制降解。但其单药减重幅度有限(10.8%),联合GLP-1类药物展现出协同放大效应,已成为新型减脂策略的典范路径。
再生元也瞄准了减重市场,开发了Myostatin抗体trevogrumab和Activin A抗体garetosmab,与司美格鲁肽临床II期联合治疗显示有效的减少了体重(13.2%),减少肌肉含量流失(肌肉保存率80.9%),提高减重质量。
下一代GLP-1R多靶点药物,从强效减重到代谢重构
单独保肌药物减重效果有限,联合下一代强效减重药物是趋势。
再生元此前与翰森制药达成交易,获得其临床III期阶段的GLP-1/GIP双受体激动剂,以扩展减脂增肌药物市场布局。
礼来与信达合作GLP-1R/GCGR双靶点激动剂玛仕度肽于6月27日获得NMPA批准上市,在临床表现突出:6mg剂量第32周减重13.38%,且针对MASH临床数据显示其可以同时改善肝脏脂肪代谢,肝脏脂肪平均降低80.2%;
作为代谢领域重要玩家,礼来更是直接布局了Retatrutide,同时靶向GLP-1R/GIPR/GCGR三靶点的药物,第24周减重17.5%,第48周减重达24.2%,将减重卷向新的高度。
体成分精准监测+靶点人源化模型,加速“减脂增肌”药效验证
百奥赛图代谢研究平台已建立覆盖广泛的肥胖与糖尿病疾病动物模型体系,并引入国际先进的小动物体成分分析平台,全面支持新一代“减脂+增肌”疗法的转化研究。围绕减脂增肌信号机制,我们还开发了一系列靶点人源化小鼠,加速药效评估与机制验证。
案例1:GLP-1R激动剂和ActRII抗体对脂肪质量和瘦体重的联合药效评估
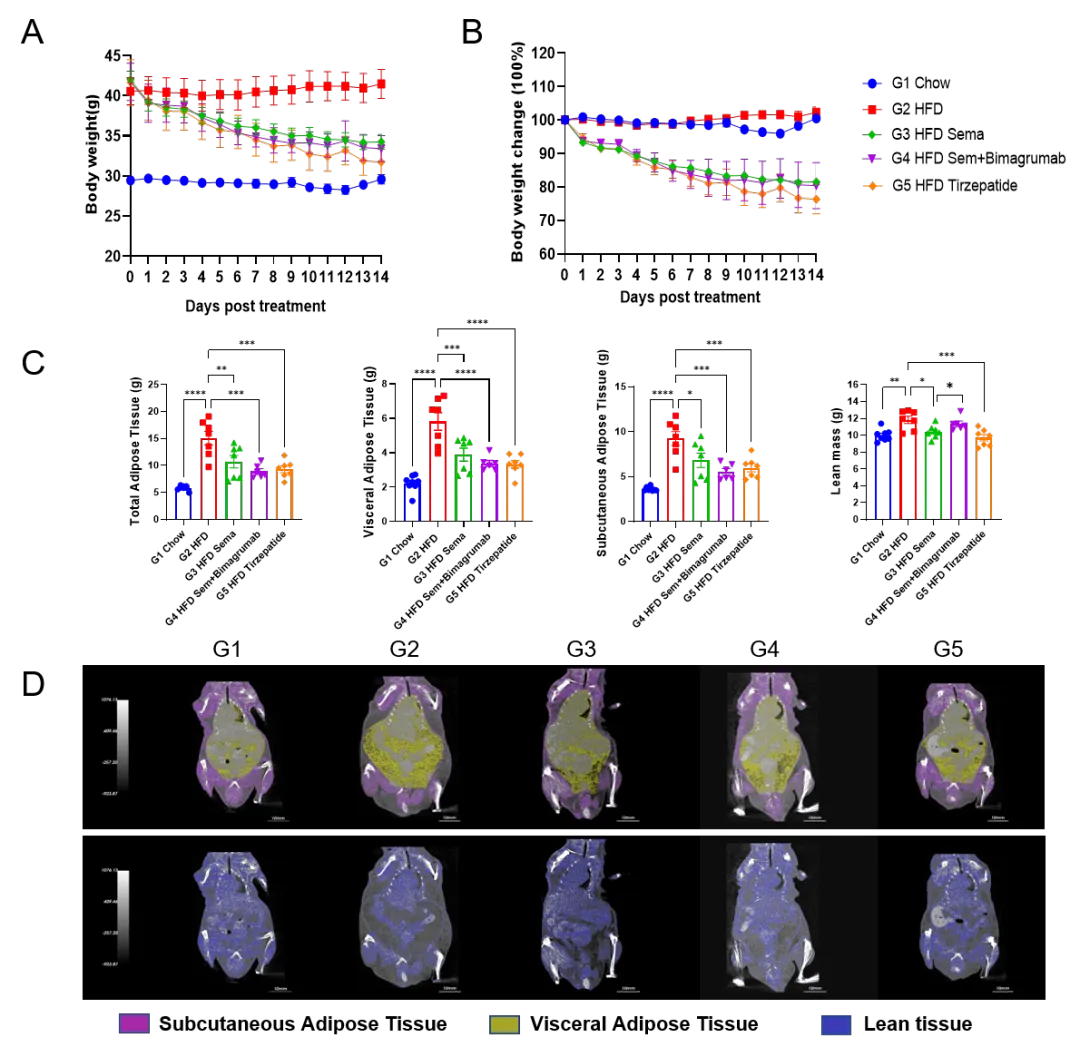
(A-B) 治疗后体重变化;(C) 通过Micro-CT扫描分析脂肪质量和瘦体重的变化;
(D) 治疗后小鼠全身脂肪组织和瘦体组织的Micro-CT影像。*p<0.05,**p<0.01,*** p<0.001,**** p<0.0001。
要验证“减脂不减肌”的药物药效,精准的体成分监测手段是不可或缺的。为支持药物研发及转化,百奥赛图引入国际先进的小动物核磁体成分分析仪(EchoMRI),实现对实验动物在无创、活体状态下的脂肪质量、瘦体重、水分含量等关键参数的实时动态检测。
案例2:高脂饮食诱导的DIO小鼠模型体成分分析
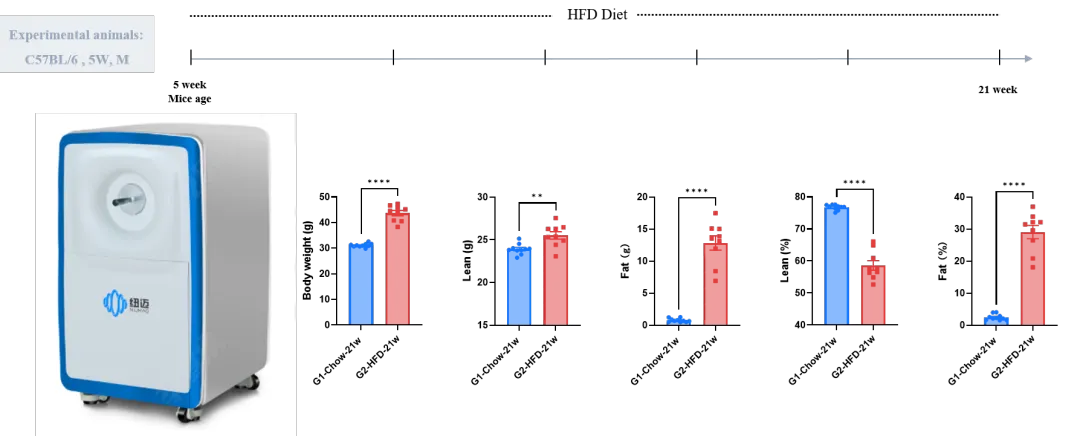
经过16周60%高脂饮食喂养后,使用体成分分析仪对小鼠的瘦体重和脂肪重量进行了分析。数据以平均值 ± SEM表示。* p < 0.05,** p < 0.01,*** p < 0.001,****p < 0.0001。
案例3:GLP-1R激动剂和GIPR抗体对B-hGIPR小鼠DIO模型的联合药效评估
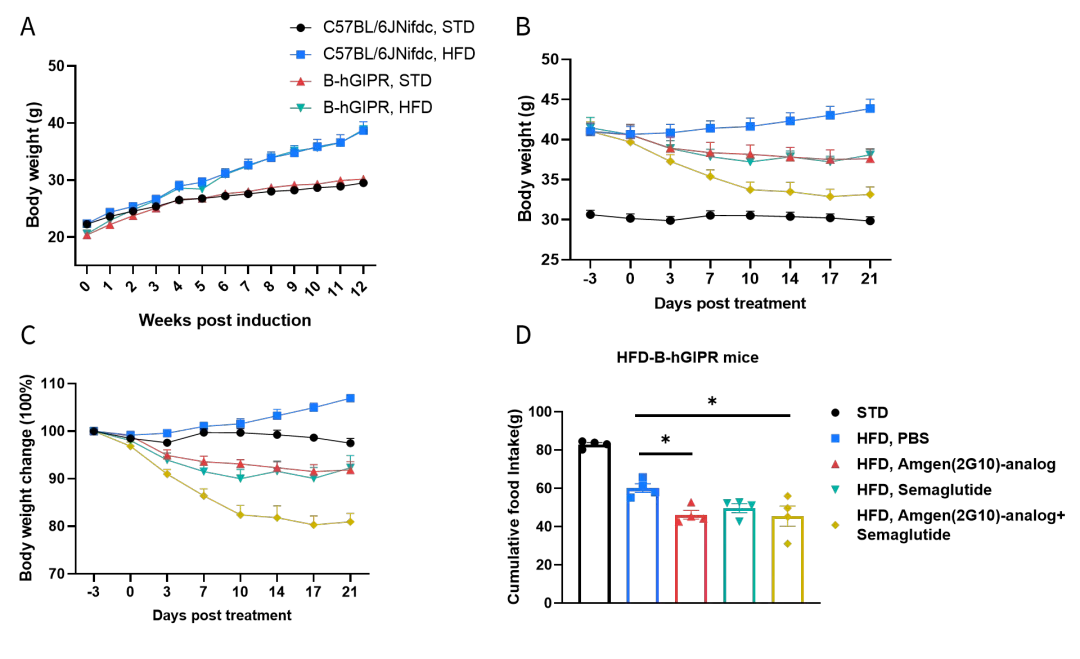
B-hGIPR 小鼠饲喂高脂饮食12周以诱导小鼠肥胖。(A)高脂饮食诱导后体重变化。(B-C)使用抗人GIPR抗体Amgen-2G10类似物(内部制备)、司美格鲁肽及其联合用药后的体重变化。(D)第21天抗人GIPR抗体Amgen-2G10、司美格鲁肽及联合用药对食物摄入量的影响。每组8只小鼠。数据以平均值 ± SEM表示。显著性通过Ordinary one-way ANOVA与HFD PBS组比较确定。*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
案例4:INHBE siRNA药物对B-hINHBE小鼠DIO模型的药效评估
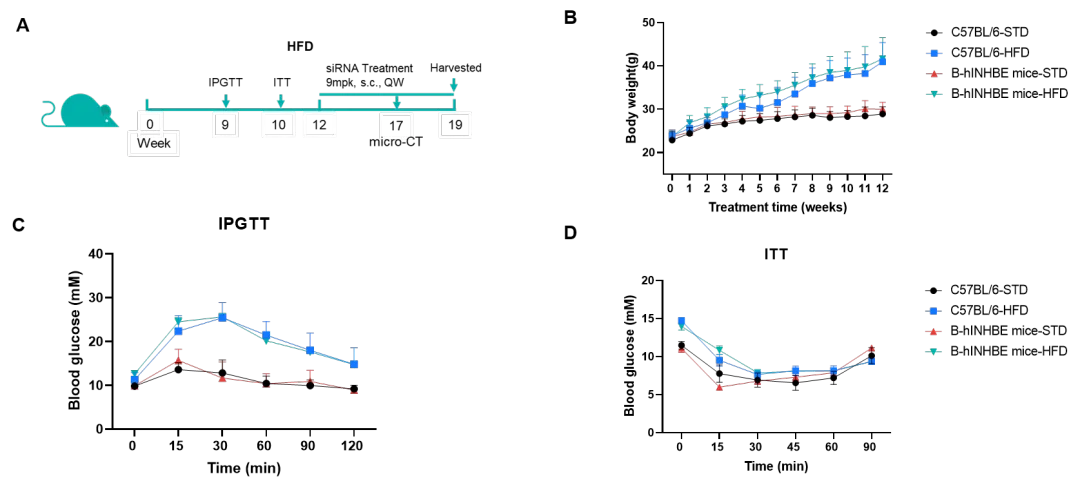
C57BL/6 和 B-hINHBE 小鼠(雄性,7周龄)饲喂高脂饮食(脂肪占比60%)12周以诱导肥胖。 (A) 实验流程示意图;(B) 高脂饮食诱导后的体重变化;(C) 在禁食6小时后,小鼠于第9周接受腹腔注射15%葡萄糖(1.5 g/kg)进行葡萄糖耐量测试(GTT);(D) 禁食4小时后,小鼠腹腔注射胰岛素(0.5 U/kg)进行胰岛素耐量测试(ITT)。
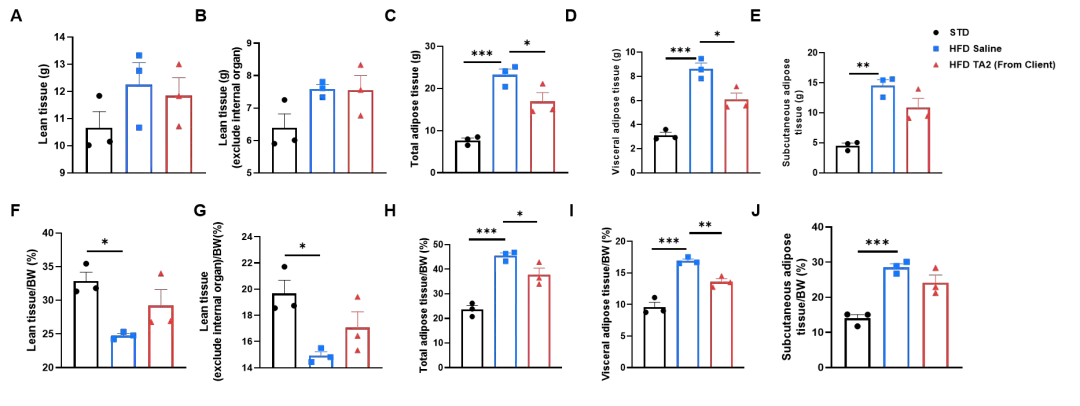
通过Micro-CT在13次给药后对小鼠的瘦组织和脂肪组织进行三维重建分析。(A-E) 分别显示瘦组织重量、去除内脏后的瘦组织重量、总脂肪组织、内脏脂肪组织和皮下脂肪组织的重量;(F-J) 分别显示上述各项组织占小鼠体重的比例,包括瘦组织、去除内脏后的瘦组织、总脂肪组织、内脏脂肪组织和皮下脂肪组织。采用单因素方差分析(one-way ANOVA)进行统计,*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
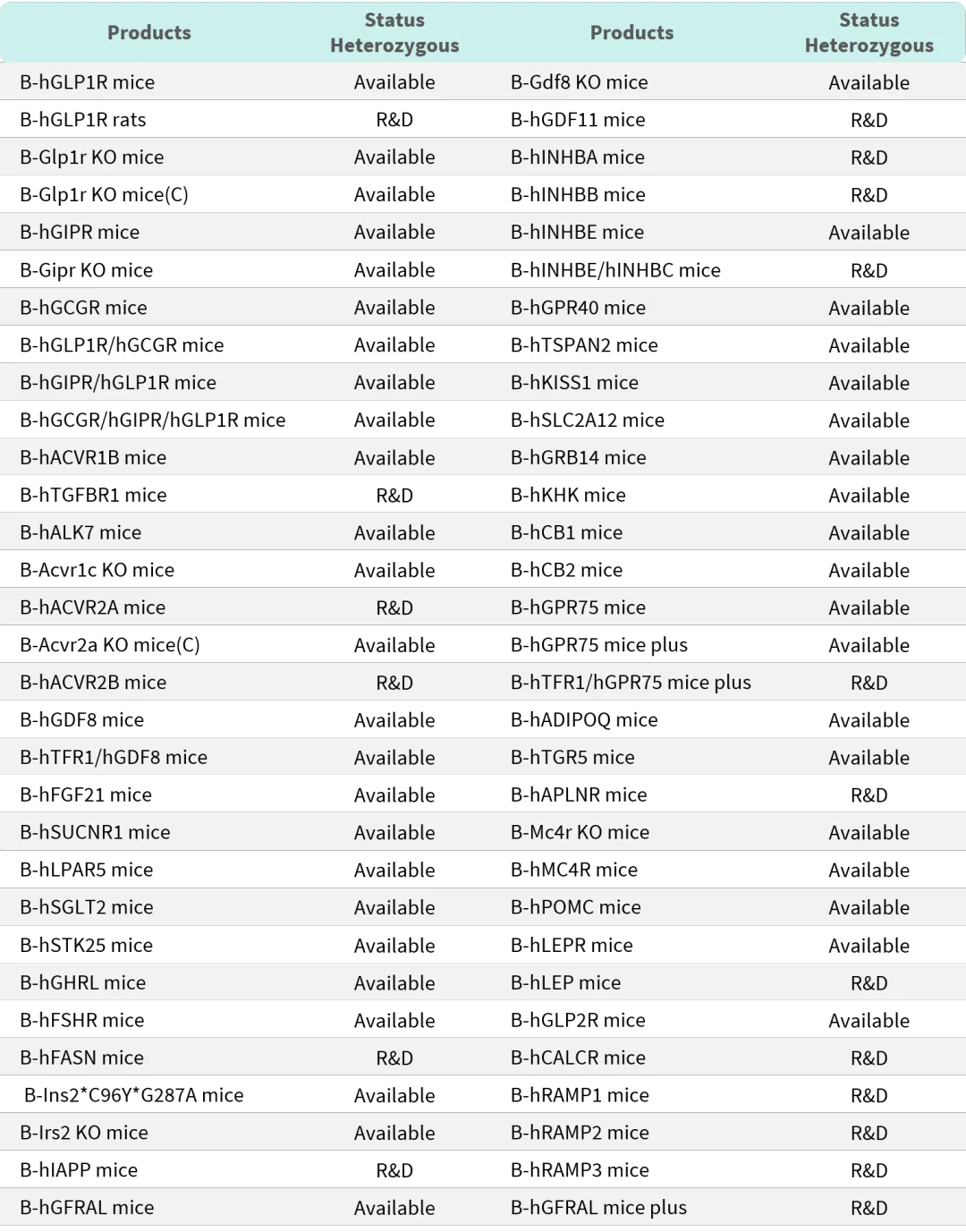
百奥赛图减脂增肌热门靶点人源化小鼠列表
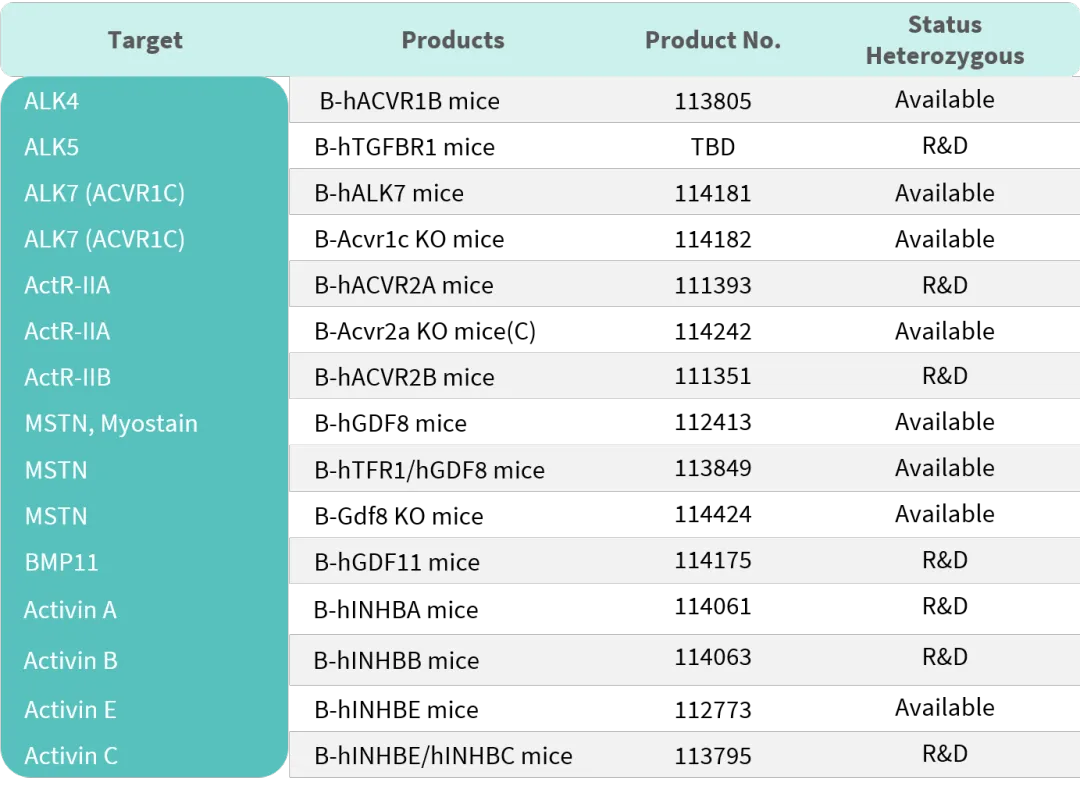
百奥赛图肥胖和糖尿病热门靶点人源化小鼠列表
随着GLP-1类药物进入快速发展阶段,减肥已不再只是“数字游戏”。真正的健康减重需要实现体成分的最优重塑——脂肪降低的同时保持甚至提升肌肉含量。以Bimagrumab为代表的新药,正在推动行业从单一药物走向多靶点协同、结构重塑、精准代谢调节的新纪元。未来“减脂+增肌”,才是下一场革命的主角。
参考资料
[1] Tsuchida, Kunihiro. Activins, Myostatin and Related TGF-β Family Members as Novel Therapeutic Targets for Endocrine, Metabolic and Immune Disorders. Current Drug Targets - Immune, Endocrine & Metabolic Disorders, 4(2), 157–166(2004).
[2] Salazar, V., Gamer, L. & Rosen, V. BMP signalling in skeletal development, disease and repair. Nat Rev Endocrinol, 12, 203–221 (2016).