在此页面上
炎症性肠病(IBD)是一种慢性复发性胃肠道炎症性疾病,包含溃疡性结肠炎(UC)和克罗恩病(CD)两种类型。炎症性肠病的临床症状通常包括反复腹泻、腹痛、肠道出血(便血)、发热及体重下降。尽管其确切机制尚未完全明确,但遗传易感性、免疫失调、环境影响及肠道菌群失衡等因素,是导致疾病发生发展的关键原因。
为深入理解疾病机制并评估新型疗法,研究人员广泛采用临床前炎症性肠病(IBD)模型及 IBD 小鼠模型,以再現人类疾病的病理特征。其中,葡聚糖硫酸钠(DSS)诱导的结肠炎模型是最成熟的在体 IBD 模型之一。将葡聚糖硫酸钠(DSS)添加到饮用水中给药时,会破坏肠道上皮屏障、激活固有免疫细胞、促进细胞因子释放并破坏黏膜完整性,进而引发结肠炎症状 —— 包括体重下降、腹泻、便血及炎症细胞浸润 —— 这些症状与人类溃疡性结肠炎(UC)高度相似。
百奥赛图利用 C57BL/6 小鼠构建的葡聚糖硫酸钠(DSS)诱导型炎症性肠病(IBD)模型,是稳定、可重复且经验证的临床前平台,可用于药物疗效评估与抗炎治疗测试。此外,百奥赛图的靶点人源化 IBD 模型(如 B-hTL1A 小鼠)能表达完整的人源 TL1A 蛋白,为靶点验证、IBD 机制研究以及与人类疾病相关的临床前药物研发,提供了更精准的转化型模型。
| Mice strains |
| B-hCXCR2 |
| B-hTL1A |
| B-hTL1A/IL23A/IL12B |
| Readout | ||
| Included tests | Clinical scores | Body weight |
| DAI score | ||
| Colon | Colon length | |
| Colon weight | ||
| Histopathology | H&E | |
| Optional tests | Tissue homogenate | Cytokines test |
| Tissue histopathology | IHC | |
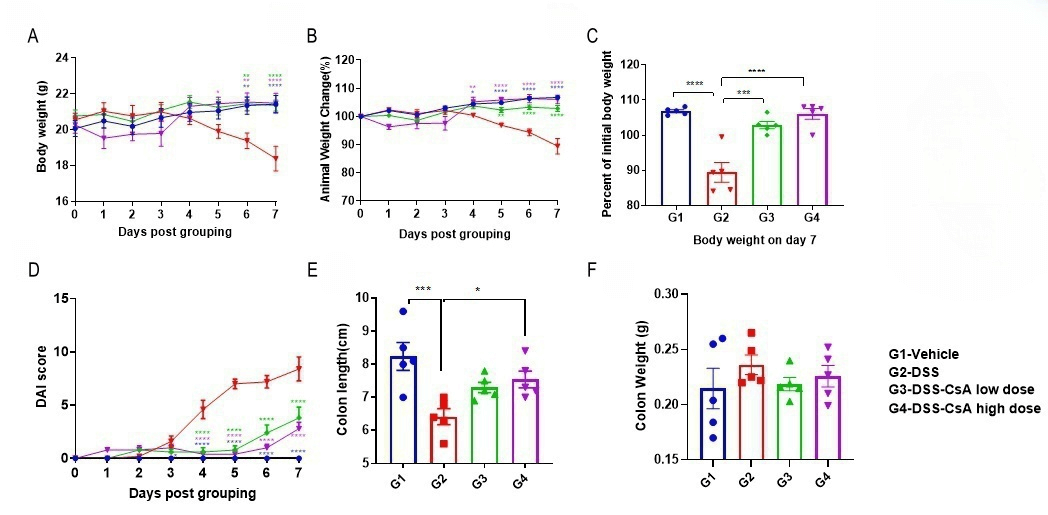
在IBD小鼠模型中验证CsA(环孢素A)的药效。 C57BL/6小鼠在连续7天内饮用含有DSS的水,整个过程中记录体重变化,并在研究终点进行临床评分(A-D),记录结肠重量和结肠长度。采用双因素ANOVA(A-D)或单因素ANOVA(E-F),并进行多重比较。结果以平均值 ± SEM表示。****p<0.0001, ***p<0.001, **p<0.01, *p<0.05。
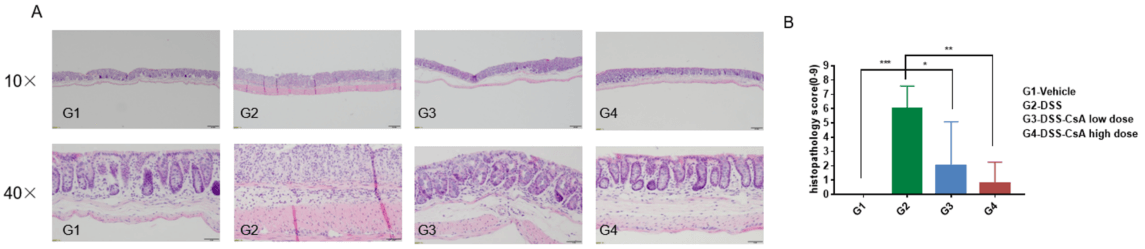
DSS诱导性IBD小鼠模型的组织学评估。组织病理评分和H&E染色的光学显微照片(10倍和40倍放大)。结果以平均值 ± 标准误差表示。****p<0.0001, ***p<0.001, **p<0.01, *p<0.05。
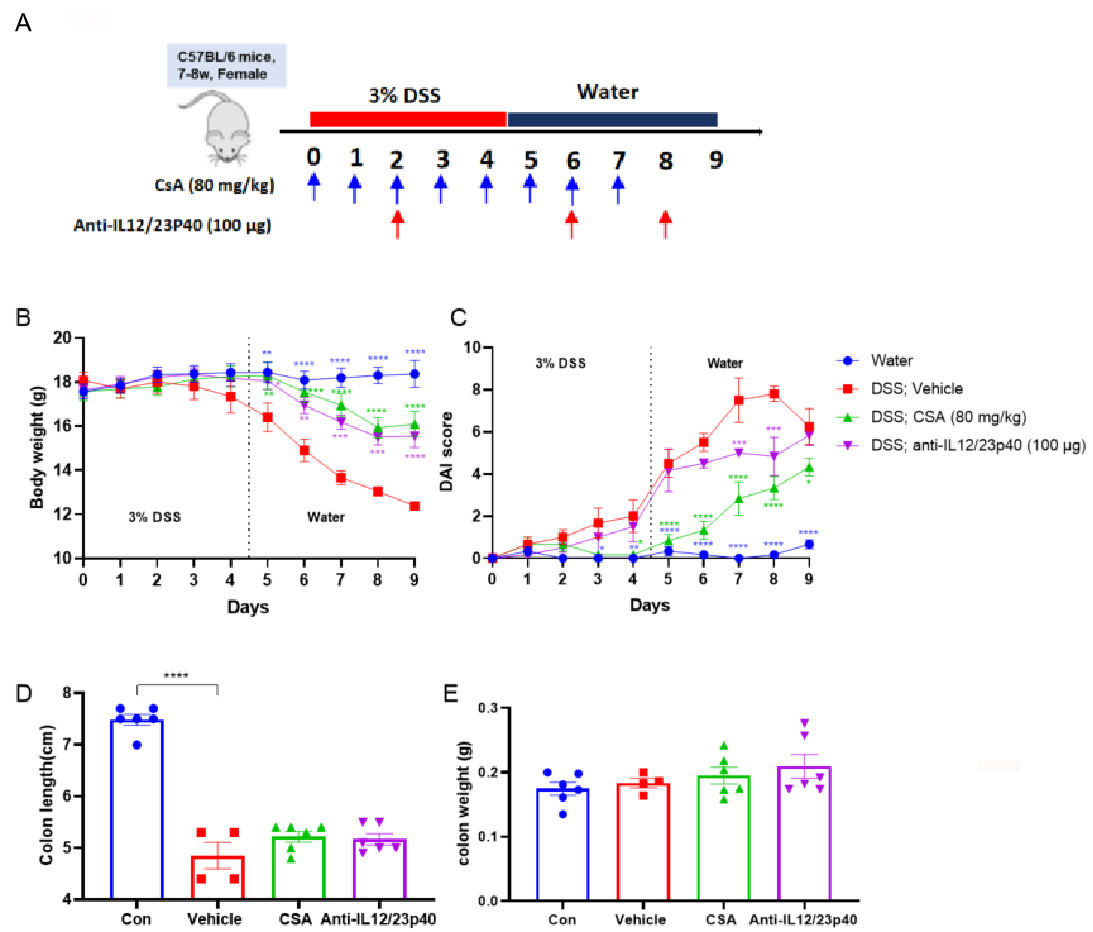
抗IL12/23p40对DSS诱导急性结肠炎的治疗效果。
C57BL/6小鼠持续5天饮用含有3% DSS的饮用水,从第0天到第7天每天给小鼠注射CsA,第2、6、8天给小鼠注射抗IL12/23P40(A)。每天记录小鼠体重和排泄物(B, C)。实验结束时采集结肠组织进行H&E染色,同时记录结肠长度(D)和重量(E)。结果显示,CsA与抗IL-12/23p40均可缓解3% DSS诱导的溃疡性结肠炎。数据分析采用双因素方差分析(Two way-ANOVA)及多重比较检验。结果以平均值 ± 标准误差表示。****p<0.0001, ***p<0.001, **p<0.01, *p<0.05。
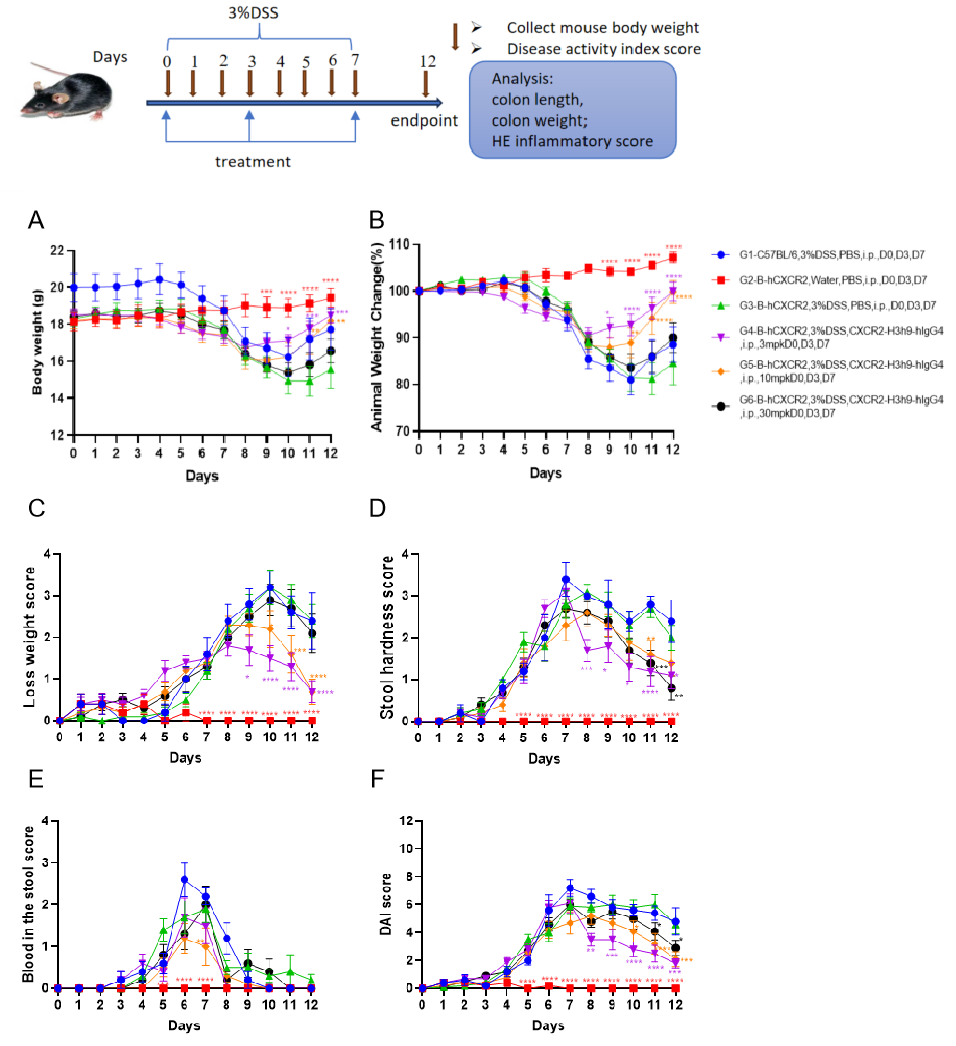
在B-hCXCR2小鼠IBD模型中进行药效验证。
C57BL/6小鼠和B-hCXCR2小鼠饮用了含有DSS的水连续7天,然后恢复正常饮水。期间记录体重变化和临床评分(体重减轻评分、大便硬度评分、大便血评分以及总DAI评分)。采用双因素ANOVA并进行多重比较,所有组与G3组比较。结果以平均值 ± 标准误差表示。****p<0.0001, ***p<0.001, **p<0.01, *p<0.05。
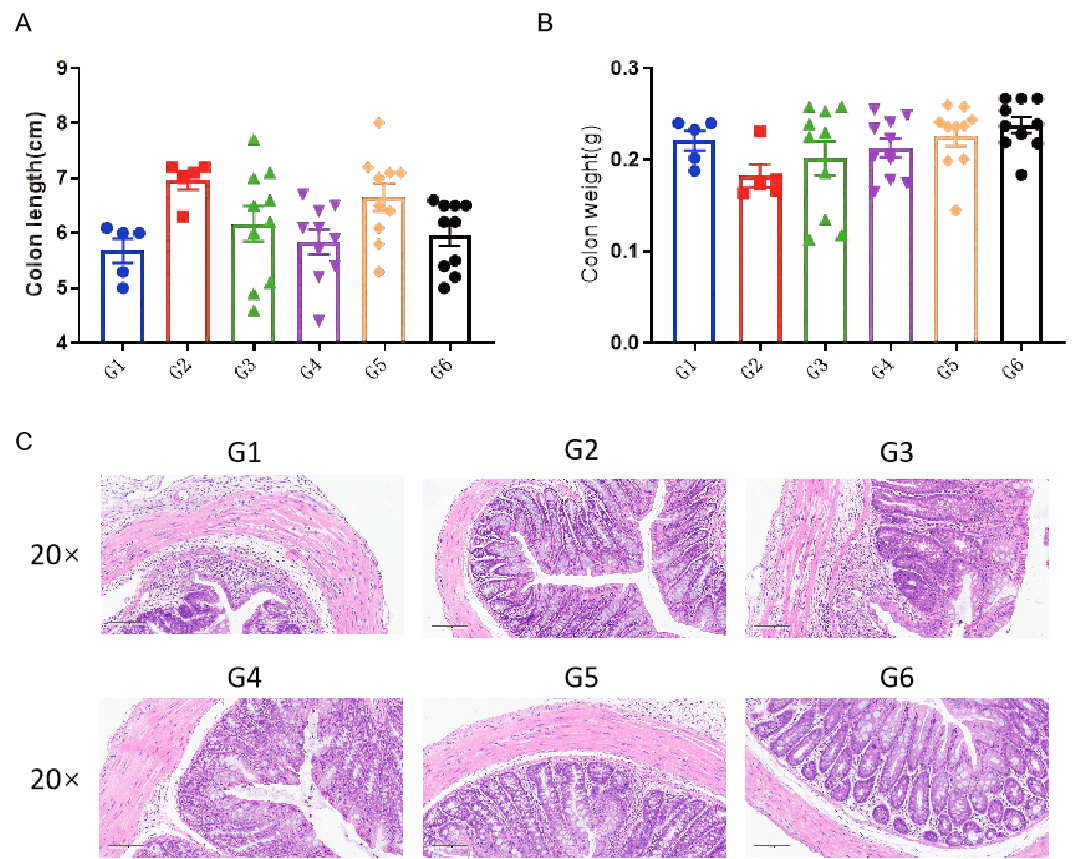
IBD小鼠模型的大体取样、结肠评估和组织学分析。 C57BL/6小鼠和B-hCXCR2小鼠饮用了含有DSS的水连续7天,然后恢复正常饮水。实验结束时测量结肠长度(A)和结肠重量(B),并对结肠组织进行H&E染色分析(C)。采用单因素ANOVA并进行多重比较,所有组与G3组比较。结果以平均值 ± SEM表示。
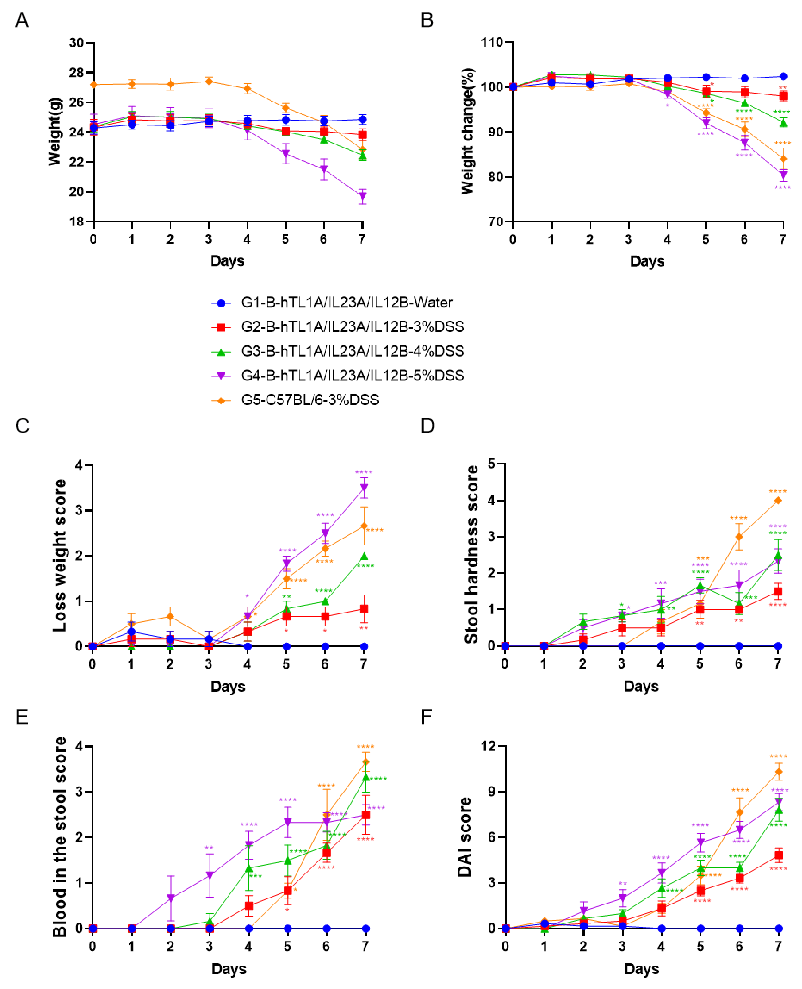
C57BL/6小鼠和B-hTL1A/hIL23A/hIL12B小鼠饮用含有不同浓度DSS的水,连续7天。记录了体重变化和临床评分(体重下降评分、大便硬度评分、大便中血液评分以及总DAI评分)。采用双因素ANOVA并进行多重比较,所有组与G1组比较。数据以均值±SEM表示。****p<0.0001,***p<0.001,**p<0.01,*p<0.05。
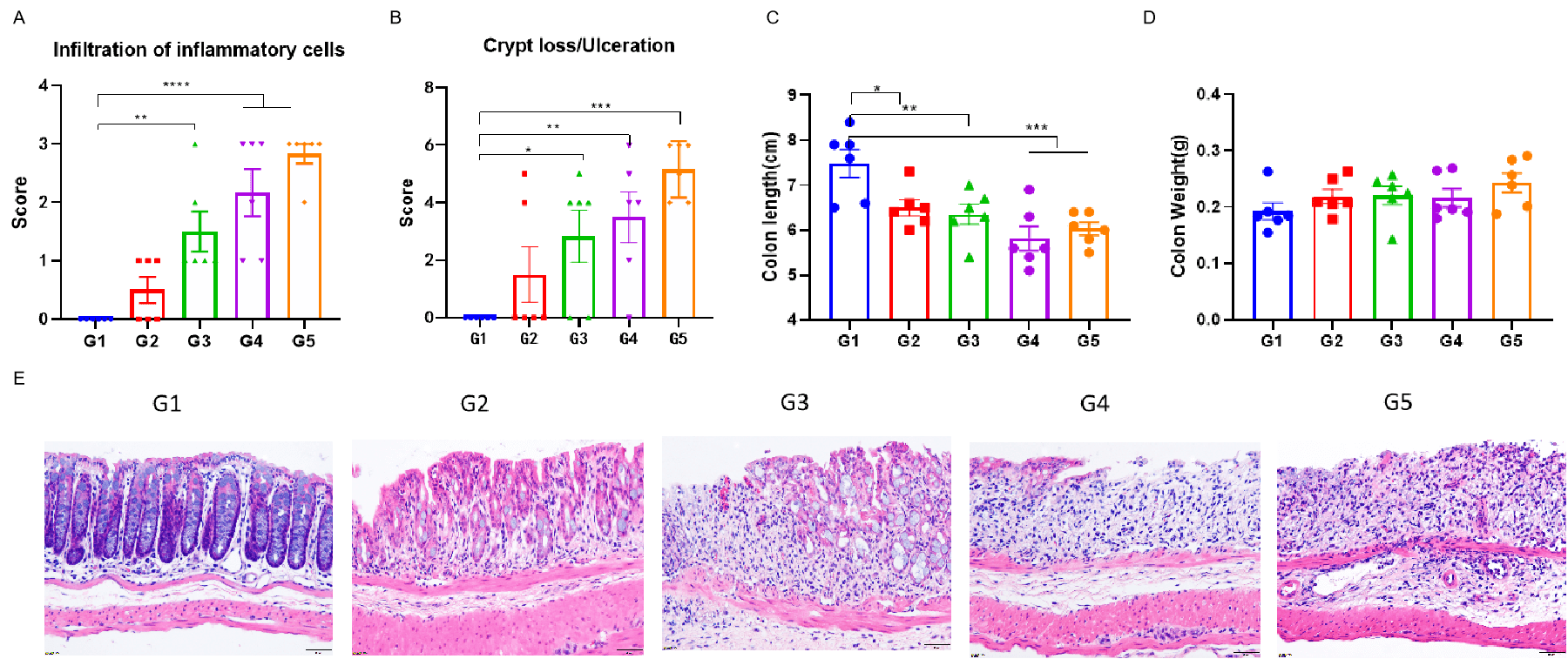
C57BL/6小鼠和TL1A/IL23A/IL12B人源化小鼠(B-hTL1A/hIL23A/hIL12B小鼠)饮用含有不同浓度DSS的水,连续7天。实验结束时,测量结肠长度和结肠重量,并对结肠组织进行H&E染色分析。使用单因素ANOVA并进行多重比较,与G1组比较。数据以均值±SEM表示。****p<0.0001,***p<0.001,**p<0.01,*p<0.05。
| Mice strains |
| B-hTL1A |
| Readout | ||
| Included tests | Clinical scores | Body weight |
| DAI score | ||
| Colon | Colon length | |
| Colon weight | ||
| Histopathology | HE | |
| Sirius Red staining | ||
| Optional tests | Tissue homogenate | Cytokines test |
| Tissue histopathology | IHC | |
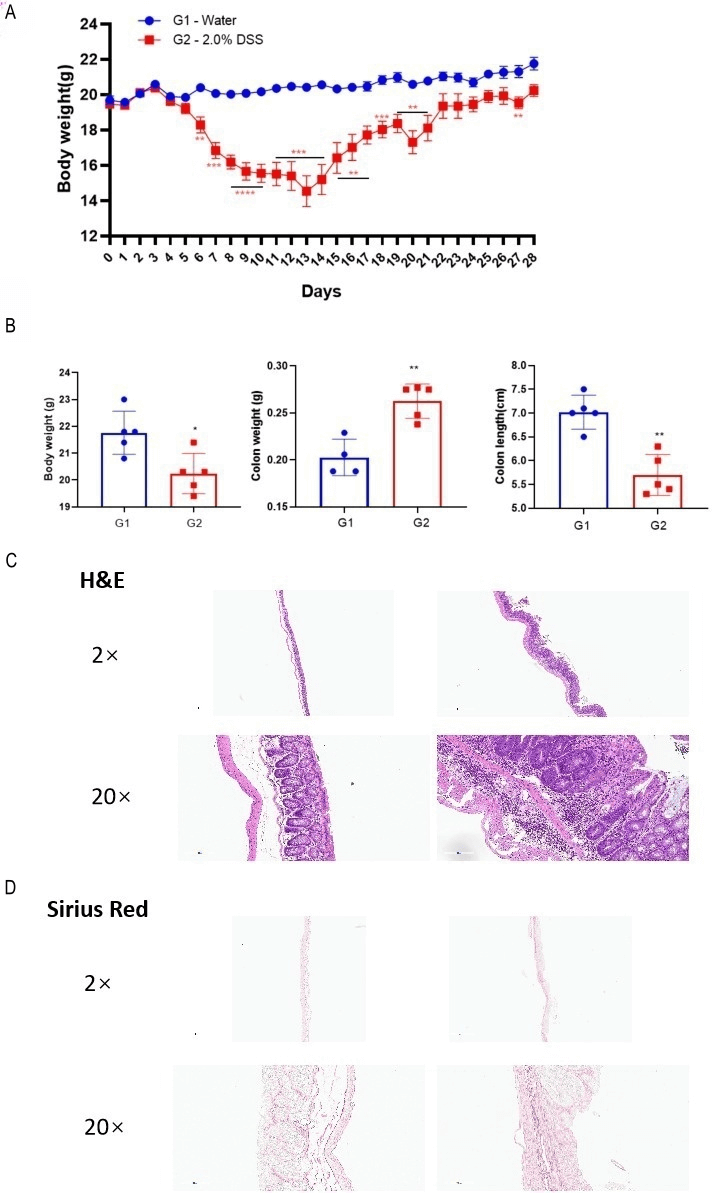
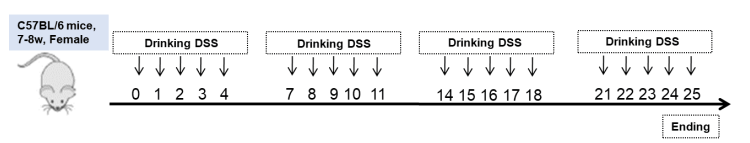
DSS诱导的慢性结肠炎模型。 小鼠反复暴露于4个DSS周期中,每个周期包含2%DSS处理5天,随后恢复饮用水处理2天(A)。记录小鼠体重、结肠重量和结肠长度(B)。采用H&E(C)和Sirius Red(D)进行组织病理学染色。收集结肠进行组织学分析。与接受正常饮用水的小鼠相比,DSS处理的小鼠体重较低,结肠重量较高,结肠长度较短。多重T检验。均值±SEM,n=5,****p<0.0001,***p<0.001,**p<0.01,*p<0.05。
| Mice strains |
| B-hTL1A |
| Readout | ||
| Included tests | Clinical scores | Body weight |
| Colon | Colon length | |
| Colon weight | ||
| Histopathology | HE | |
| Optional tests | Tissue homogenate | Cytokines test |
| Tissue histopathology | IHC | |
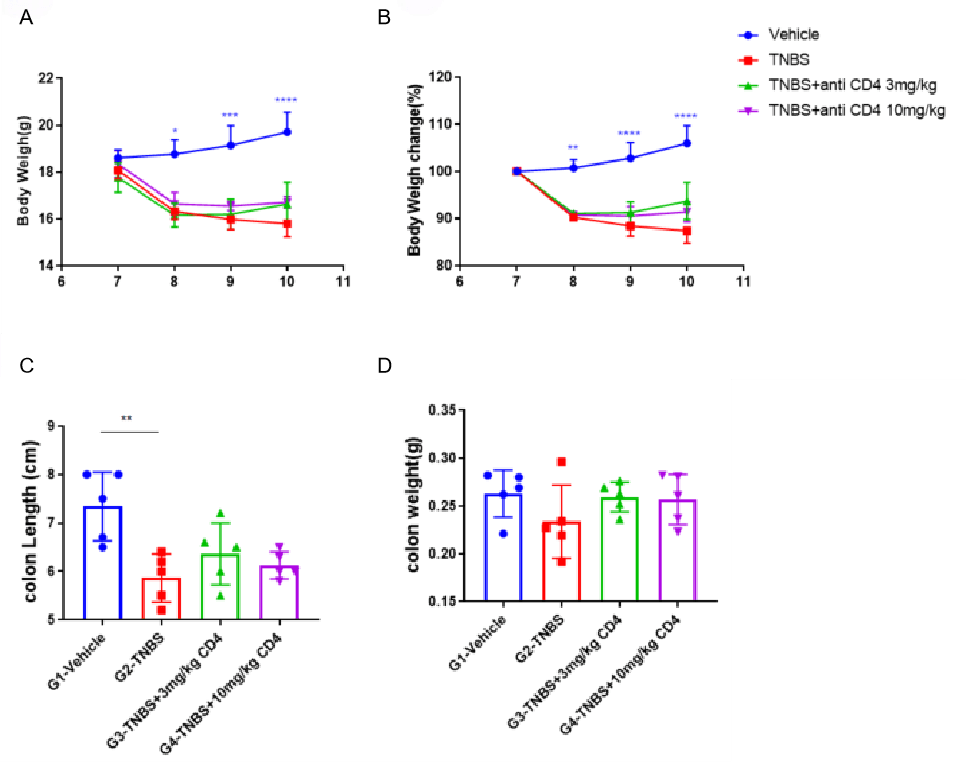
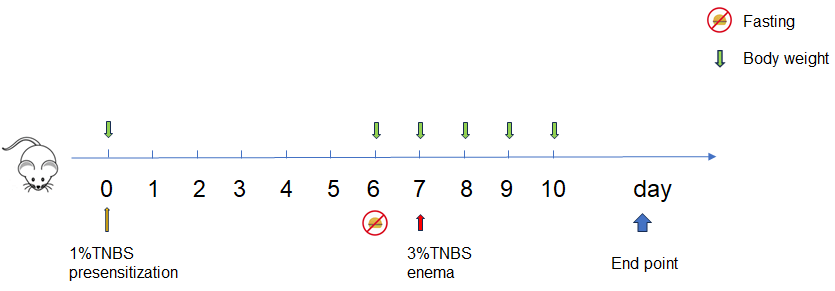
CD4-GK1.5-mlgG2a对TNBS诱导的急性肠道炎症的治疗效果。 动物在第0天于剃毛皮肤区域进行TNBS预致敏处理,第7天经直肠给予TNBS溶液诱导肠炎。实验期间每日记录体重(A)及体重变化(B),第6天给予CD4-GK1.5-mlgG2a(3, 10 mg/kg,i.p.)。第10天处死小鼠,记录结肠长度(C)和重量(D)。采用双因素ANOVA或单因素ANOVA并进行Dunnett多重比较分析,各组相互比较。数据以均值±SEM表示。****p<0.0001,***p<0.001,**p<0.01,*p<0.05。
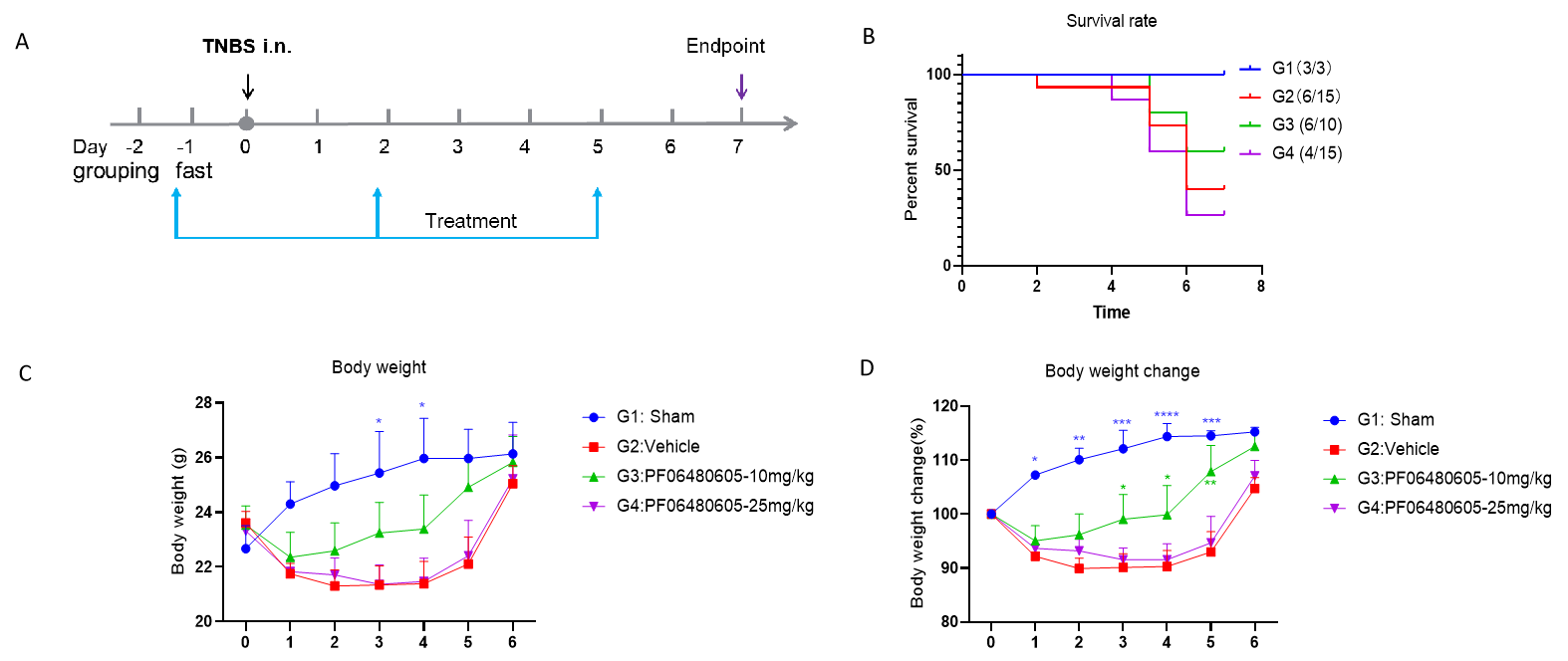
PF06480605对TNBS诱导的B-hTL1A小鼠中急性IBD模型的药效。 动物于第0天经直肠给予TNBS溶液。TA治疗组于第-1天、第2天和第5天给予10或25 mg/kg的PF06480605。方案示意图如(A)所示。分析计算存活率(B),并记录每天的体重变化(C-D)。采用双因素ANOVA并进行Dunnett多重比较,各组与G2组比较。数据以均值±SEM表示。****p<0.0001,***p<0.001,**p<0.01,*p<0.05。
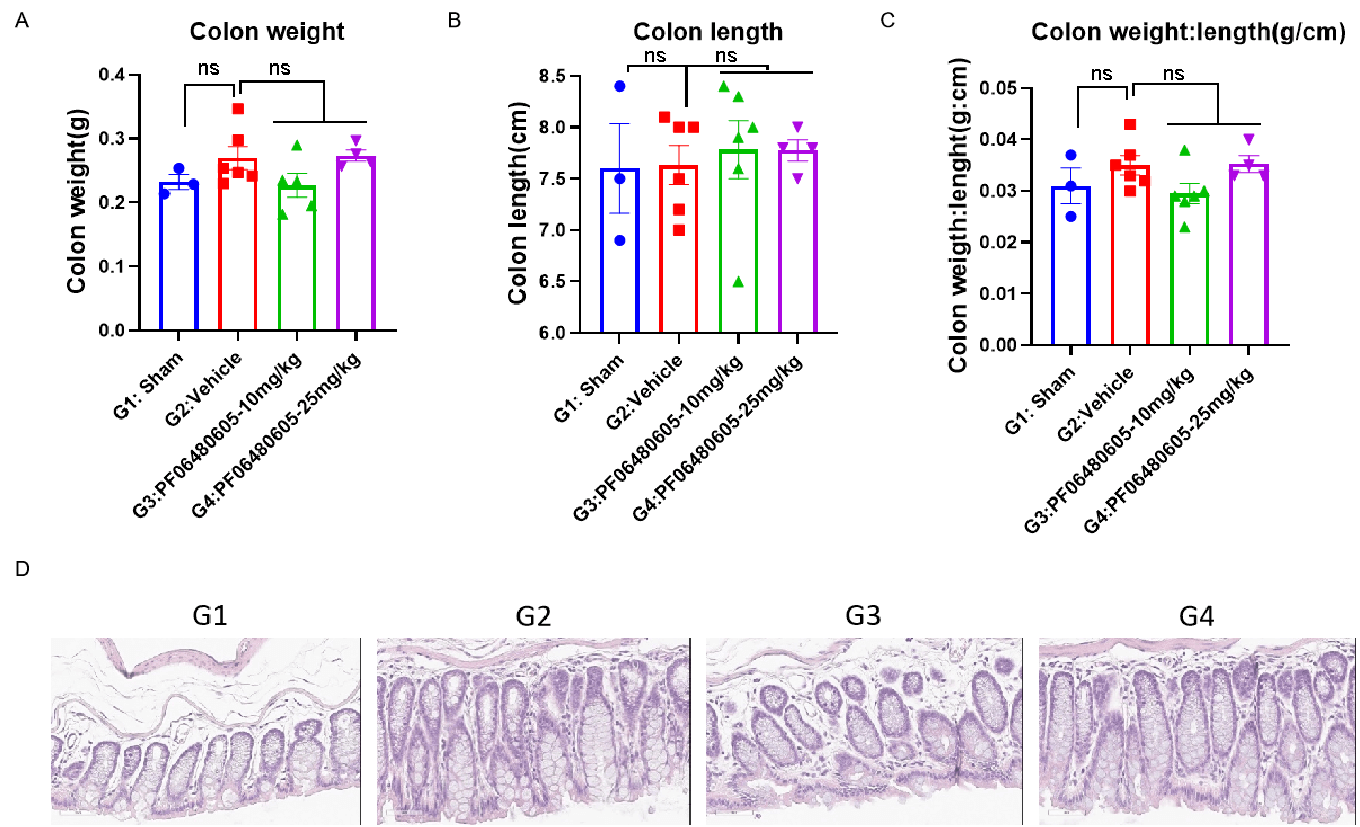
动物于第0天经直肠给予TNBS溶液。记录小鼠每天的体重并分析计算存活率。TA治疗组于第-1天、第2天和第5天分别给予10或25 mg/kg的PF06480605。在第7天,小鼠被处死并记录结肠重量(A)和结肠长度(B)。随后对结肠组织进行H&E染色。采用单因素ANOVA并进行多重比较。所有组与G2组比较。数据以均值±SEM表示。****p<0.0001,***p<0.001,**p<0.01,*p<0.05。
| Mice strains |
| B-hPSGL1(spleen donor) |
| Readout | ||
| Included tests | Clinical scores | Body weight |
| DAI score | ||
| Colon | Colon length | |
| Colon weight | ||
| Histopathology | H&E | |
| Optional tests | Tissue homogenate | Cytokines test |
| Tissue histopathology | IHC | |
| Histopathology | Sirius Red staining | |
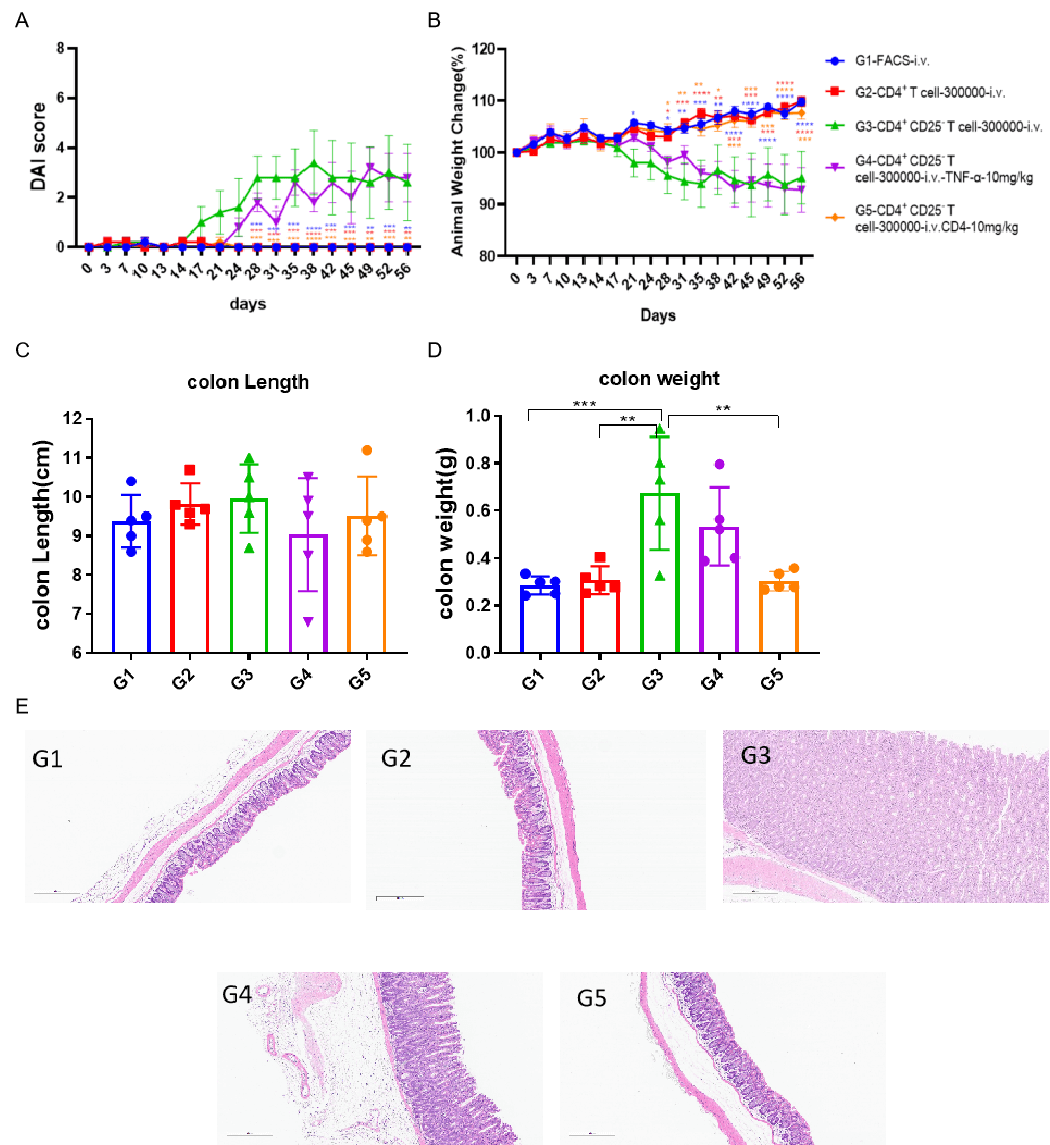
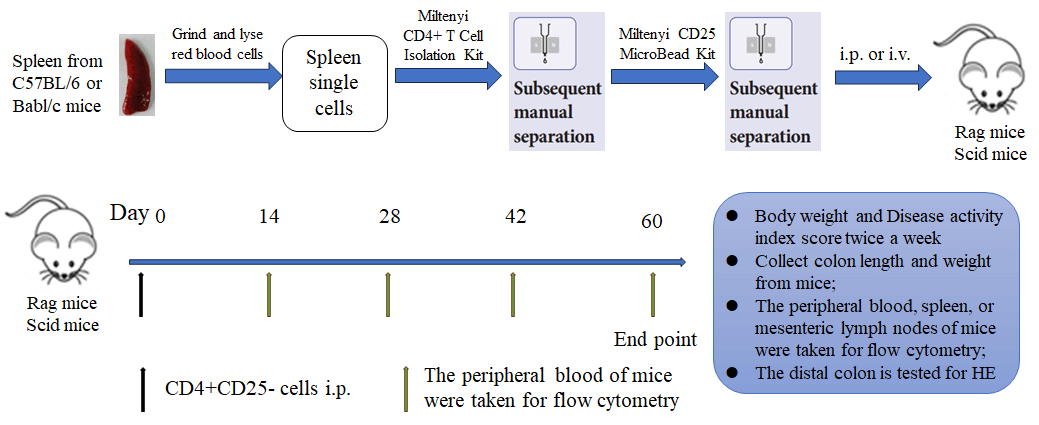
转移性T细胞诱导IBD模型的药效。
使用商业试剂盒从Balb/c小鼠脾脏中提取CD4+CD25- T细胞或CD4+ T细胞。G2组动物注射3×105 CD4+ T细胞,G3-G5组动物注射相同数量的CD4+CD25- T细胞。治疗时,G4组动物每周给予10 mg/kg的抗TNFα抗体,G5组动物每周给予10 mg/kg的抗CD4抗体。采用双因素ANOVA或单因素ANOVA并进行多重比较,各组与G3组比较。数据以均值±SEM表示。****p<0.0001,***p<0.001,**p<0.01,*p<0.05。