在此页面上
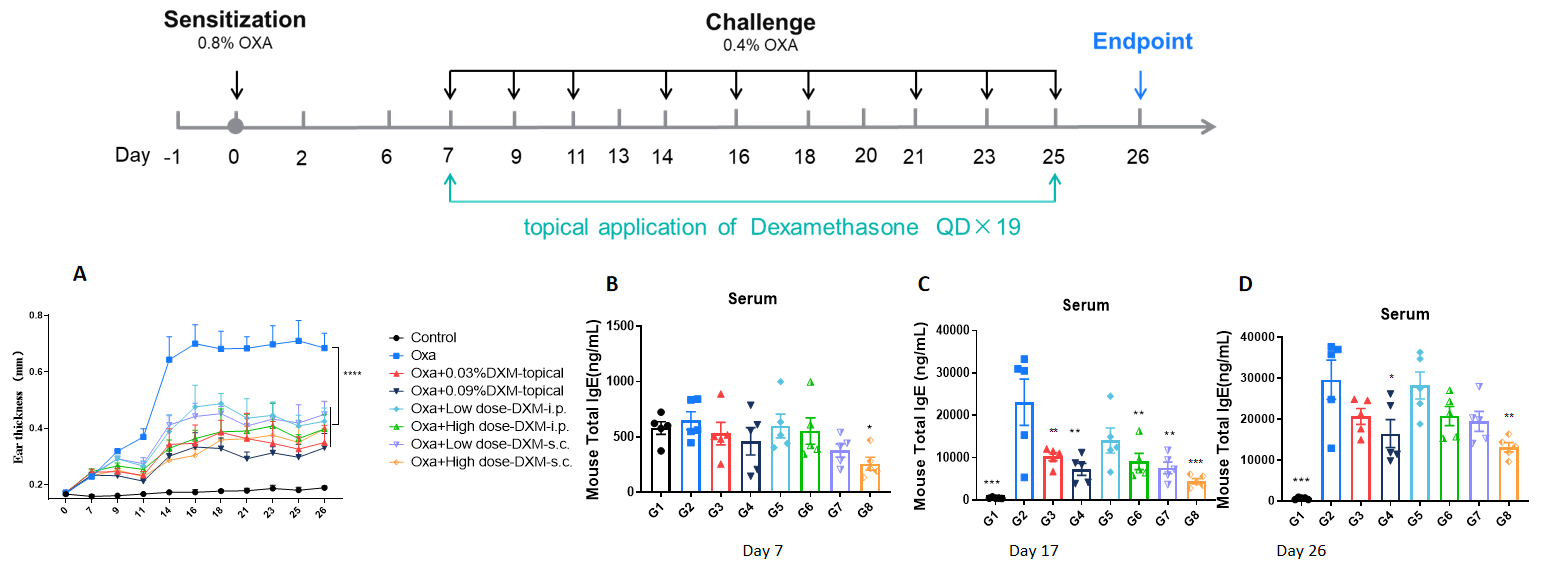
靶向EGFR的抗肿瘤药物在B-NDG小鼠中的抗肿瘤活性。(A) 分子靶向的小分子抗肿瘤药物轻微抑制了BP0062在B-NDG小鼠中的肿瘤生长。BP0062的PDX模型被皮下注射到B-NDG小鼠中(雌性,6周龄,n=6)。当肿瘤体积达到约100 mm³时,将小鼠分组并进行不同靶向药物的治疗,具体时间表如图中所示。(B) 治疗过程中体重变化。如图A所示,分子靶向小分子抗肿瘤药物有效,证明BP0062的PDX模型可以用来建立肿瘤模型,并为具有EGFR阳性细胞的胰腺肿瘤提供强有力的临床前模型。数据以均值±SEM表示。
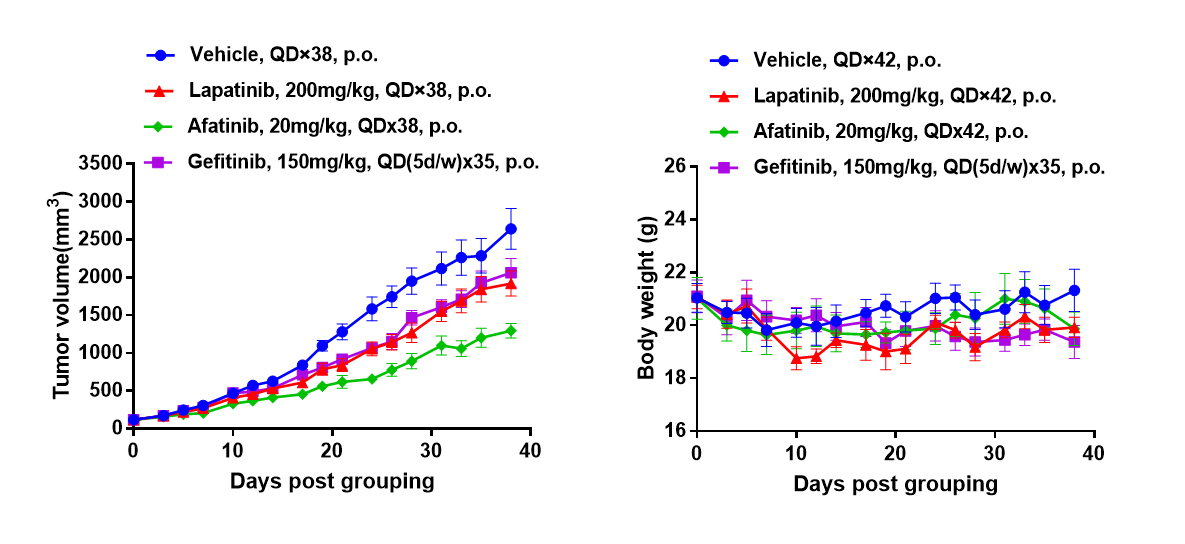
B-NDG小鼠中吉西他滨的抗肿瘤活性。(A) 吉西他滨对B-NDG小鼠中BP0062肿瘤的生长有轻度抑制作用。将BP0062的PDX模型皮下移植到B-NDG小鼠(雌性,6周龄,n=6)。当肿瘤体积达到约100 mm³时,将小鼠分组,并按照图示方案接受不同靶向药物治疗。(B) 治疗期间的体重变化。数据以平均值±SEM表示。
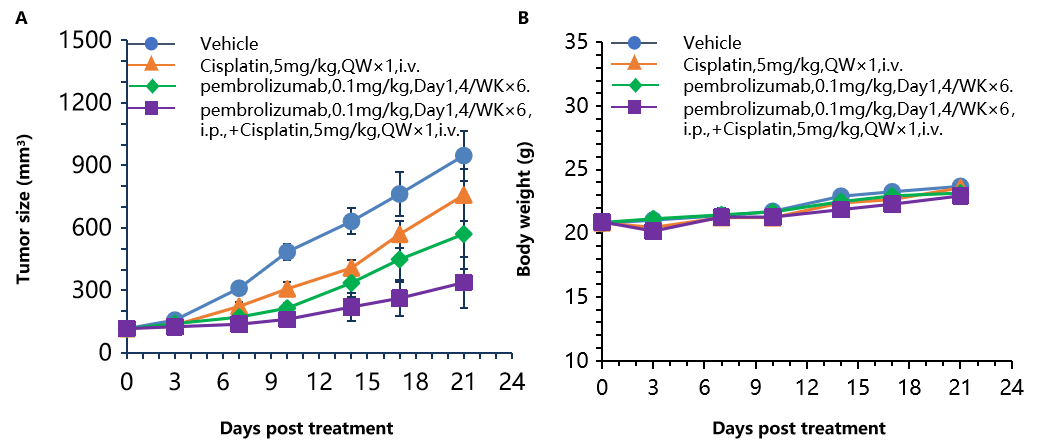
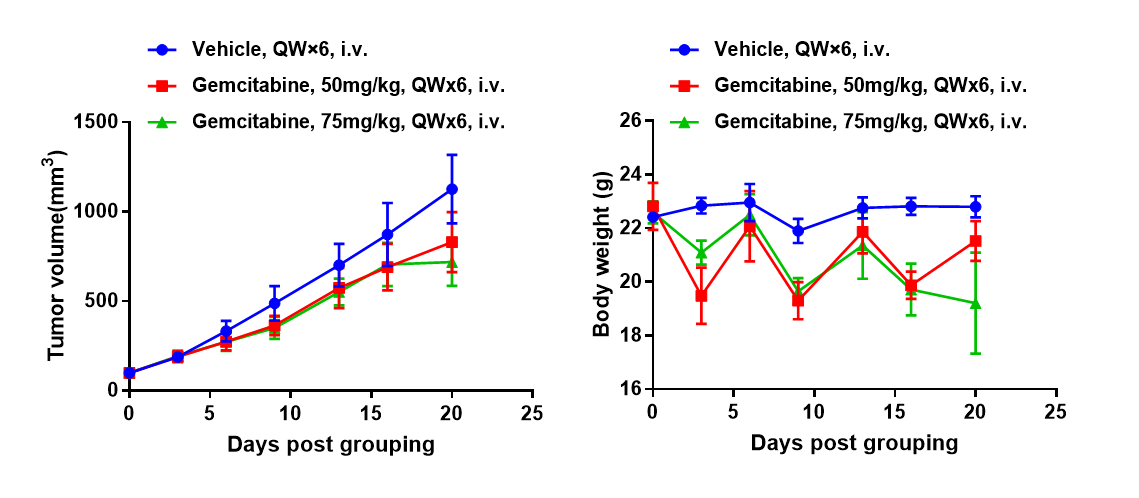
B-hPD-1小鼠中抗人PD-1抗体联合顺铂的抗肿瘤活性。(A) 抗人PD-1抗体联合顺铂抑制了B-hPD-1小鼠中MC38-hPD-L1肿瘤的生长。将小鼠结肠癌MC38-hPD-L1细胞(5×10⁵)皮下移植于纯合B-hPD-1小鼠(雌性,5-8周龄,n=8)。当肿瘤体积达到约150±50 mm³时,将小鼠分组,并按照图示剂量和方案给予抗人PD-1抗体和顺铂治疗。(B) 治疗期间体重变化。如图A所示,抗人PD-1抗体与化疗药物顺铂联合组的抑瘤效果优于单一用药组,表明B-hPD-1小鼠是评估抗人PD-1抗体与化疗药物联合治疗体内疗效的有力临床前模型。数据以均数±SEM表示。
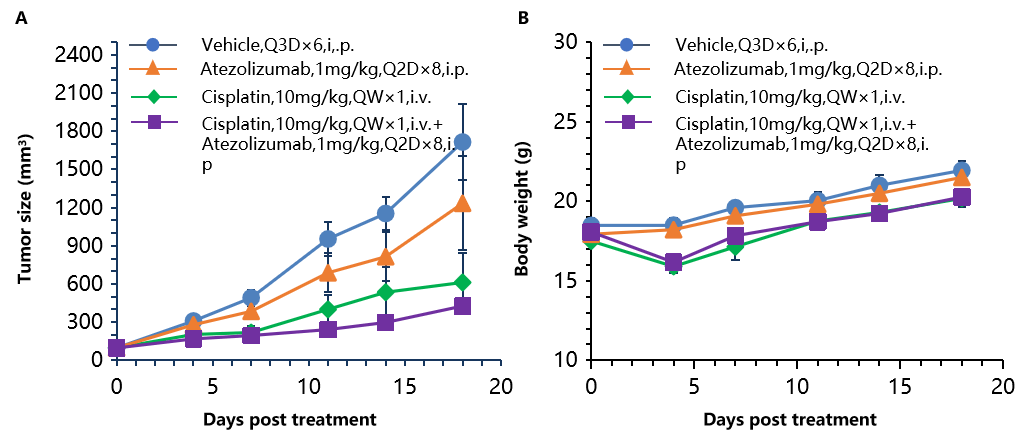
抗人PD-L1抗体(Atezolizumab)与顺铂联合治疗在B-hPD-1小鼠中的抗肿瘤活性。(A) 抗人PD-L1抗体与顺铂联合治疗抑制了B-hPD-1小鼠中MC38-hPD-L1肿瘤的生长。小鼠结肠癌MC38-hPD-L1细胞(5×10⁵)皮下接种到同源B-hPD-1小鼠(雌性,5-8周龄,n=8)。当肿瘤体积达到约150±50 mm³时,按图示剂量和治疗计划给予抗人PD-L1抗体和顺铂治疗。(B) 治疗过程中的体重变化。如图A所示,抗hPD-L1抗体与化疗药物顺铂的联合疗法比单独治疗组具有更有效的肿瘤抑制作用,证明B-hPD-1小鼠为抗人PD-L1抗体和化学药物联合治疗的体内药效评估提供了有力的前临床模型。数据以均值±SEM表示。
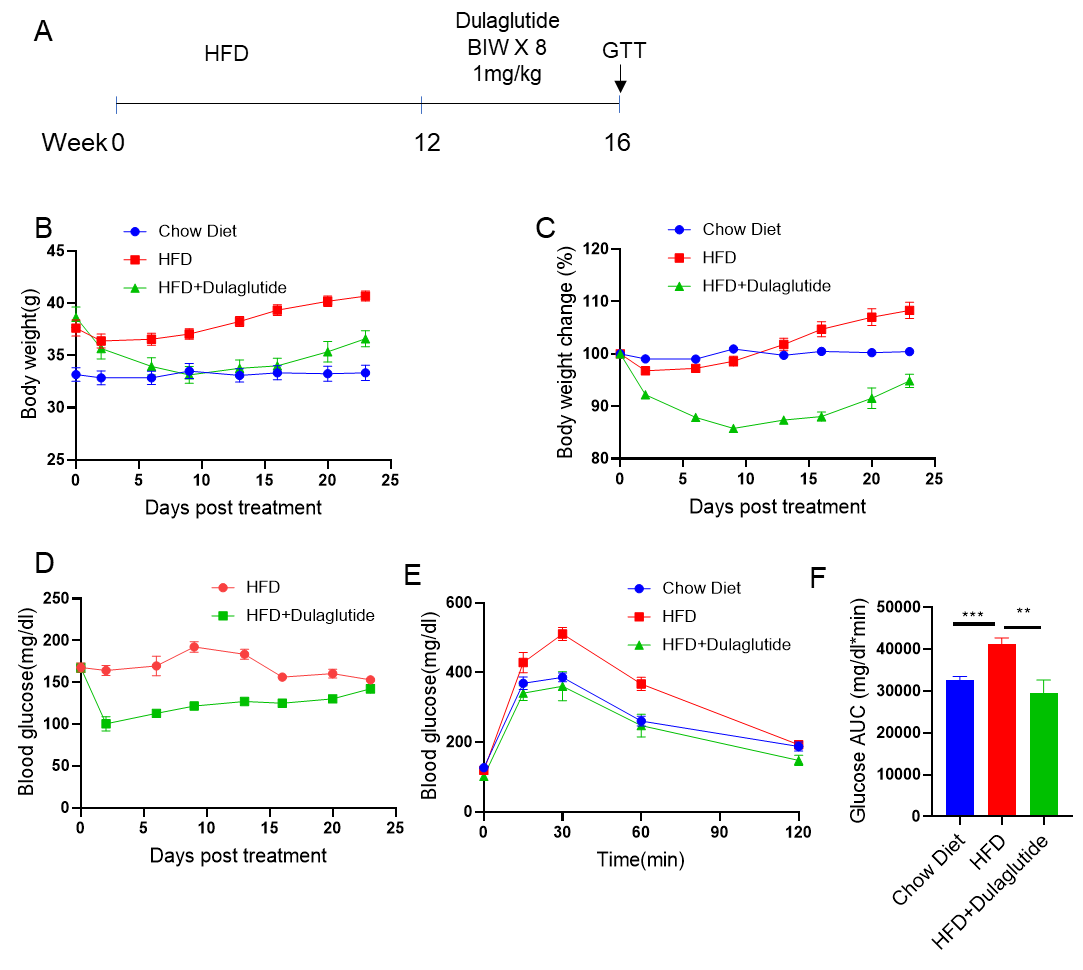
C57BL/6小鼠喂食高脂饮食(60 kcal%脂肪)12周以诱导肥胖。Dulaglutide(内部制备)通过皮下注射,每周两次,持续4周后开始分组。(B,C) 体重、(D,E) 血糖以及(F) 葡萄糖耐受实验结果如上所示。(每组n=5只小鼠)。数据以均值±SEM表示。*** p<0.001, ** p<0.01。(每组n=8只小鼠)
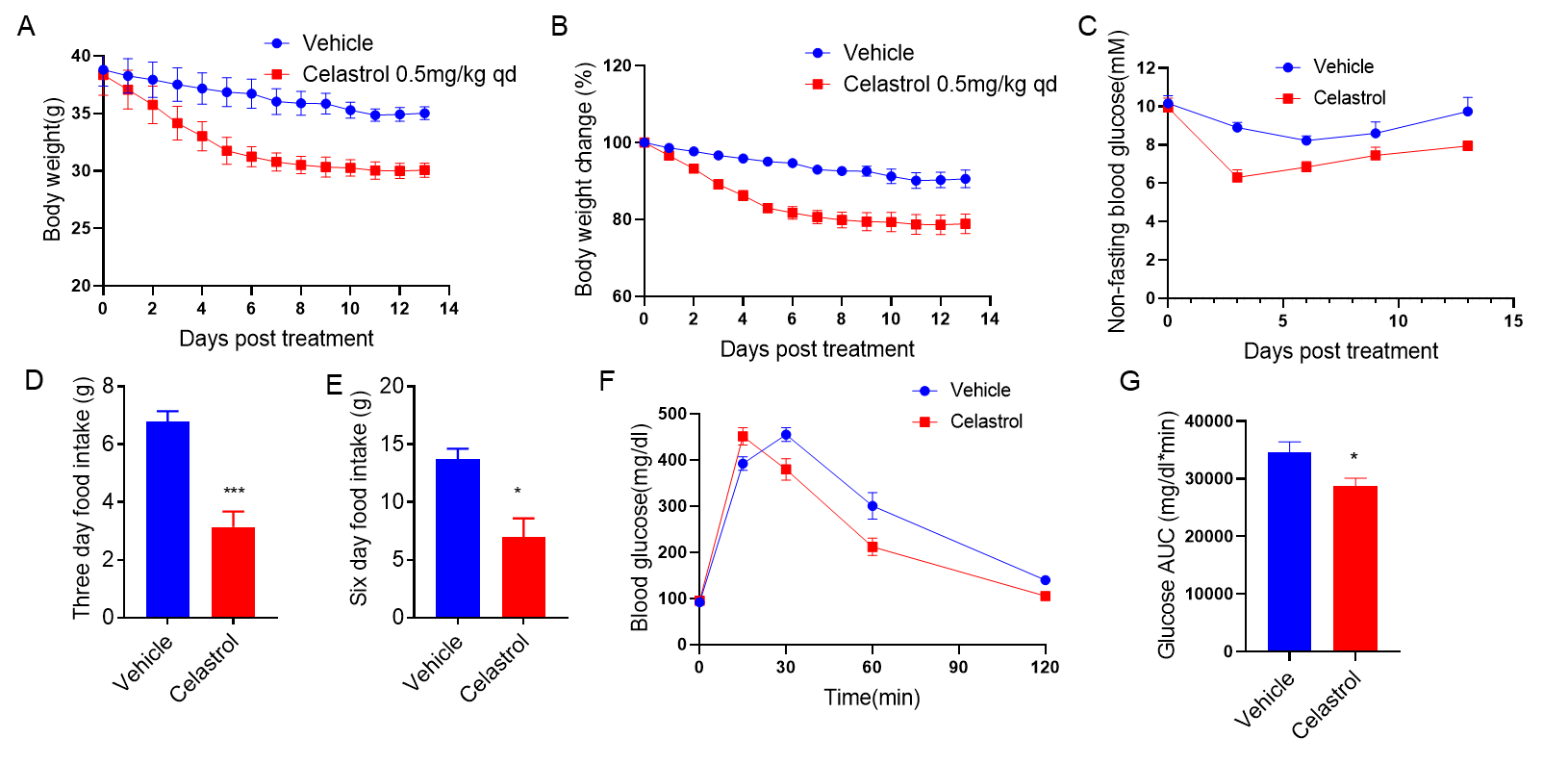
C57BL/6小鼠喂食高脂饮食(60 kcal%脂肪)12周以诱导肥胖。然后小鼠每天腹腔注射载体或Celastrol(0.5mg/kg),持续14天。(A,B) 体重、(C) 血糖、(D,E) 食物摄入量和(F,G) 葡萄糖耐受性实验结果如上所示。数据以均值±SEM表示。*** p<0.001。(每组n=5只小鼠)