在此页面上
肿瘤疫苗指的是将肿瘤抗原以多种形式,如患者来源的肿瘤细胞、肿瘤相关蛋白或多肽、表达肿瘤抗原的基因等,通过人工合成的方式将这些抗原辅以佐剂或通过树突状细胞等作为递送载体,制备成疫苗制剂导入患者体内。疫苗进入体内后,肿瘤抗原被DC细胞吞噬,继而被加工呈递给T细胞,激活抗原特异性细胞毒性T细胞,从而杀伤肿瘤。最理想的肿瘤特异性抗原是由肿瘤细胞基因突变产生,在正常组织中不表达的新生抗原(neoantigen),它可以被递呈到细胞表面和MHC分子结合后,被T细胞识别。
疫苗已从单纯的预防手段发展为兼具治疗功能的应用,其类型涵盖传统的蛋白疫苗、肽疫苗,以及先进的mRNA疫苗等。百奥赛图基于HLA人源化小鼠和HLA人源化肿瘤细胞株,构建了多种免疫原性评估模型和肿瘤治疗效果模型。这些模型使小鼠的抗原提呈细胞(APCs)能够呈递和识别与人类相同或相似的肽表位,从而加速肿瘤疫苗的开发。同时,我们还建立了先进的体内与体外研究平台,能够全面评估疫苗的免疫原性、有效性、作用机制及安全性。
| Immunogenicity validation | Efficacy validation | MOA exploration |
|
|
|
疫苗评估的动物模型:
同种移植模型:
异种移植模型:
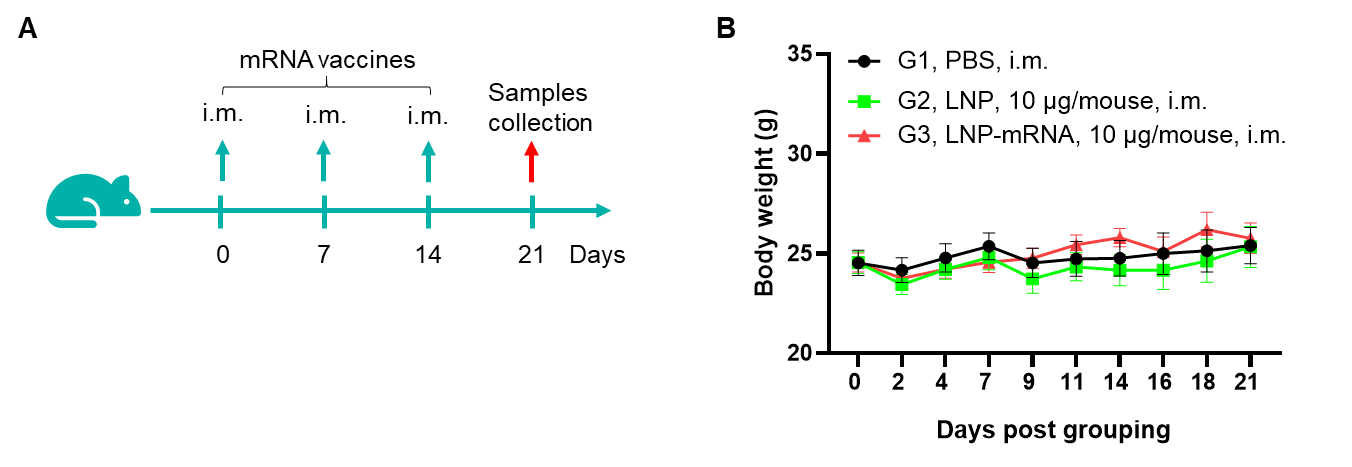
图1. 在B-HLA-A2.1小鼠中检测mRNA疫苗诱导的免疫反应。6-8周龄的雌性B-HLA-A2.1小鼠分为PBS组和mRNA疫苗组(n = 6),分别在双腿内侧肌肉注射PBS或疫苗。最后一次免疫后1周处死小鼠,提取脾细胞,用特异性肽段或与靶标无关的多肽作为阴性对照(NC)进行刺激,然后检测IFN-γ分泌和抗原特异性T细胞。(A)实验方案。(B)各组间体重无显著差异。数据以均值±SEM表示。
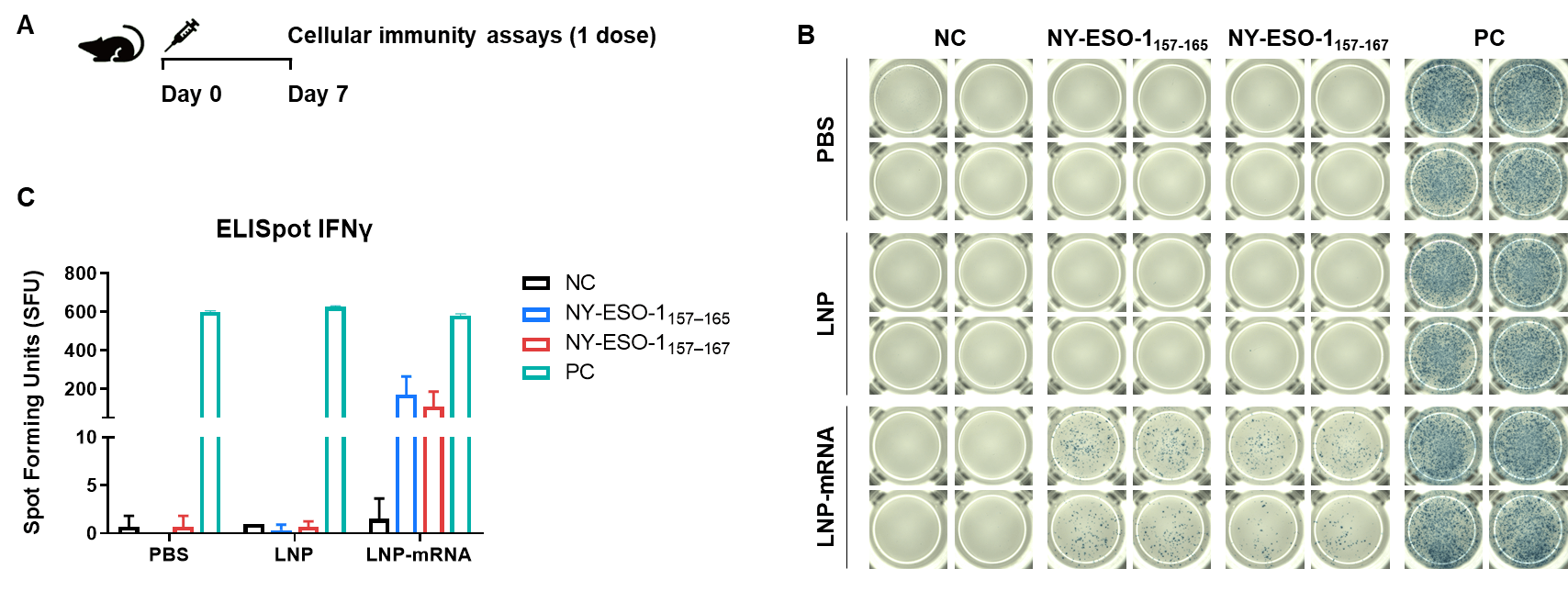
图2. 使用IFN-γ ELISpot测定法检测B-HLA-A2.1小鼠中mRNA疫苗诱导的免疫反应。(A)疫苗接种和检测方案。9-10周龄的雄性B-HLA-A2.1小鼠分为PBS组、LNP组和LNP-mRNA组(n = 3),分别在双腿内侧肌肉注射PBS、LNP或LNP-mRNA,每组仅免疫一次。免疫后1周处死小鼠,提取脾细胞,用特异性肽、无肽(阴性对照)或PMA/Ionomycin(阳性对照)刺激后检测IFN-γ分泌。(B)免疫小鼠脾细胞分别用阴性对照肽、疫苗肽和阳性对照刺激后的代表性检测结果(重复两次)。(C)检测结果汇总,数据以均值±SEM表示。NC:阴性对照。PC:阳性对照。

图3. 使用IFN-γ ELISpot测定法检测B-HLA-A2.1小鼠中mRNA疫苗诱导的免疫反应。(A)疫苗接种和检测方案。9-10周龄的雄性B-HLA-A2.1小鼠分为PBS组、LNP组和LNP-mRNA组(n = 3),在双腿内侧肌肉分别注射PBS、LNP或LNP-mRNA。。小鼠共免疫3次,间隔1周。最后一次免疫后1周处死小鼠,分离脾细胞,用特异性肽段、无肽(阴性对照)或PMA/Ionomycin(阳性对照)刺激后检测IFN-γ分泌。(B)免疫小鼠脾细胞分别用阴性对照肽、疫苗肽和阳性对照刺激后的代表性检测结果(重复两次)。(C)结果总结。数据以均值±SEM表示。NC:阴性对照。PC:阳性对照。
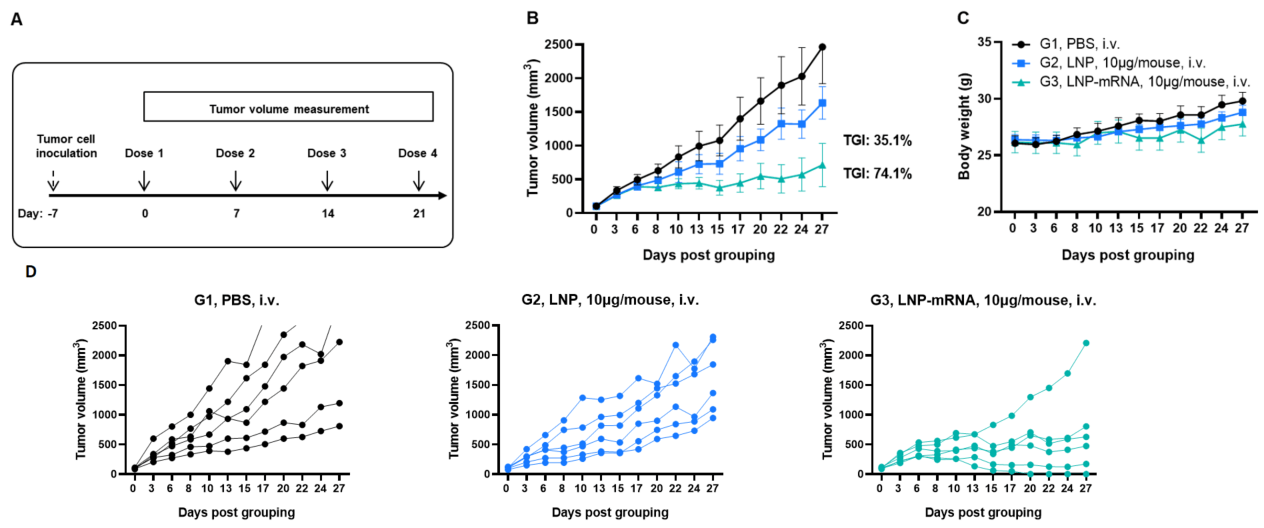
图1. LNP-mRNA对同种异体肿瘤的抗肿瘤活性。(A)实验方案。(B)LNP或LNP-mRNA治疗的抗肿瘤活性。B-HLA-A2.1小鼠(n = 6 /组)分别接种PBS、LNP或LNP-mRNA(10 μg/只)。将B-HLA-A2.1/hNY-ESO-1 MC38细胞接种到小鼠右侧腹部。(C)治疗过程中的体重变化。如图B所示,LNP-mRNA在B-HLA-A2.1小鼠中有效控制肿瘤生长。(D)mRNA对同种异体肿瘤的抗肿瘤活性。B-HLA-A2.1/hNY-ESO-1 MC38肿瘤细胞在各小鼠中的生长。数据以均值±SEM表示。
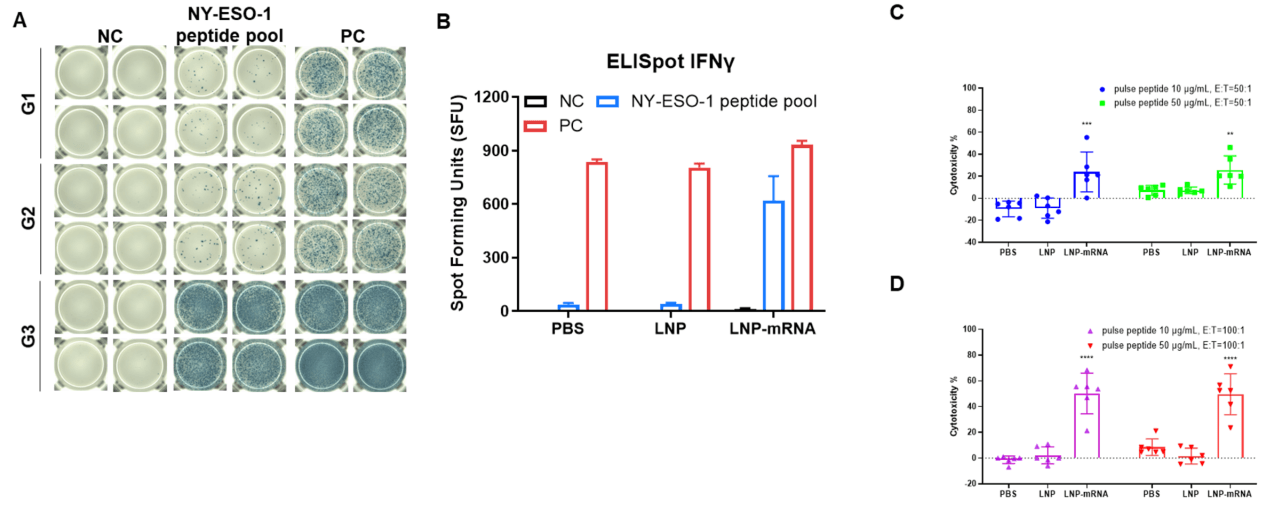
图2.(A和B)使用IFN-γ ELISpot测定法检测B-HLA-A2.1小鼠中疫苗诱导的免疫反应。NC:阴性对照。PC:阳性对照。(C和D)LDH释放实验检测来自B-HLA-A2.1小鼠的CTLs对B-HLA-A2.1/hNY-ESO-1 MC38细胞系的细胞毒性。通过LDH释放实验检测从免疫小鼠的脾细胞分离出的CTLs对NY-ESO-1肽脉冲的B-HLA-A2.1/hNY-ESO-1 MC38细胞系的细胞杀伤活性,效应细胞与靶细胞比率为50:1或100:1,使用两种不同的肽浓度,10μg或50μg。数据以均值±SEM表示。统计分析使用单因素方差分析(ANOVA)和Dunnett的多重比较测试,对每个治疗组与PBS组进行比较 **p<0.01, ***p<0.001, ****p<0.0001。
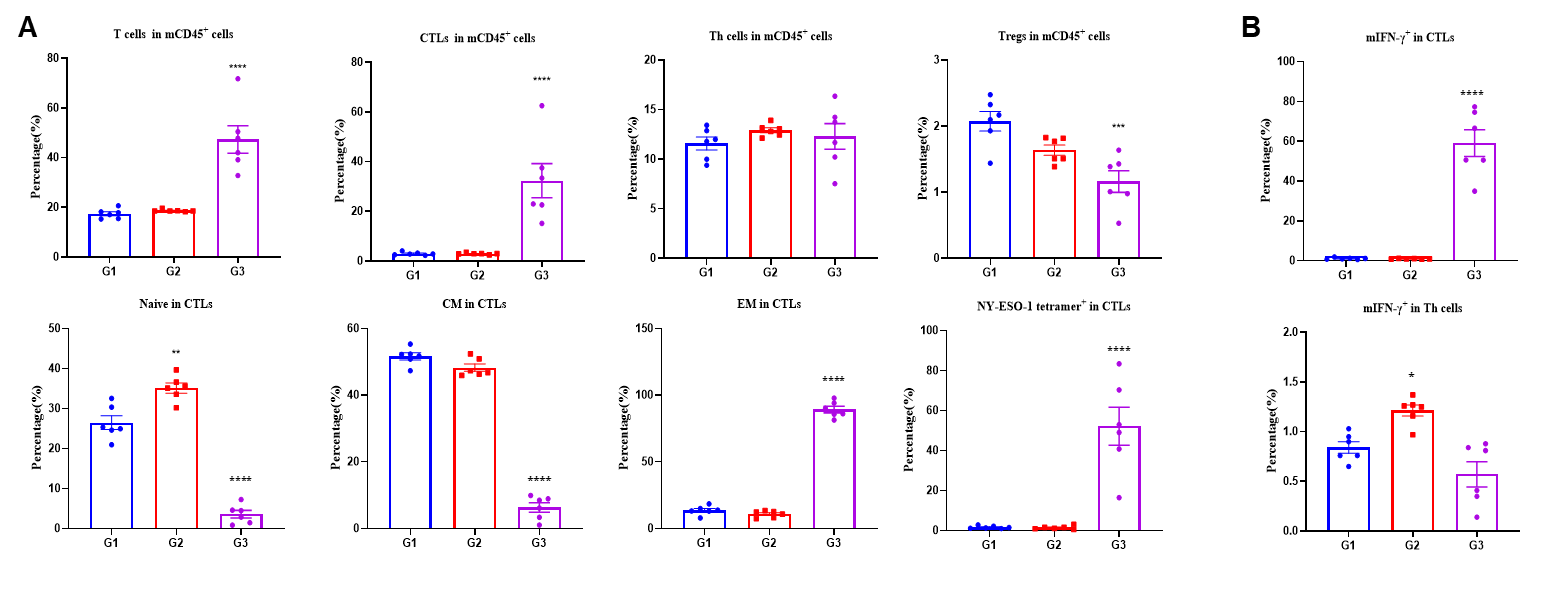
图3. mRNA疫苗接种在脾脏中生成特异性效应CD8+ T细胞。从接种PBS、LNP、LNP-mRNA疫苗的B-HLA-A2.1/hNY-ESO-1 MC38肿瘤小鼠脾脏中提取的脾细胞。(A)采用流式细胞术检测脾脏中CD8+ T细胞、CD4+ T细胞和Tregs的比例。结果显示,在CD45+细胞中,T细胞和CD8+ T细胞的比例显著升高。mRNA疫苗诱导的四聚体阳性CD8+ T细胞占总CD8+ T细胞的比例约为50%。这些CD8+ T细胞在初始型和中心记忆型中的比例较低,主要分布于效应记忆型群体中。(B)从免疫小鼠分离的脾细胞经NY-ESO-1肽刺激后进行胞内细胞因子染色分析。IFN-γ主要由CD8+ T细胞分泌,而不是CD4+ T细胞。数据以均值±SEM表示。统计分析使用单因素方差分析(ANOVA)和Dunnett的多重比较测试,对每个治疗组与G1组进行比较。*p<0.05, **p<0.01, ***p<0.001, ****p<0.0001。
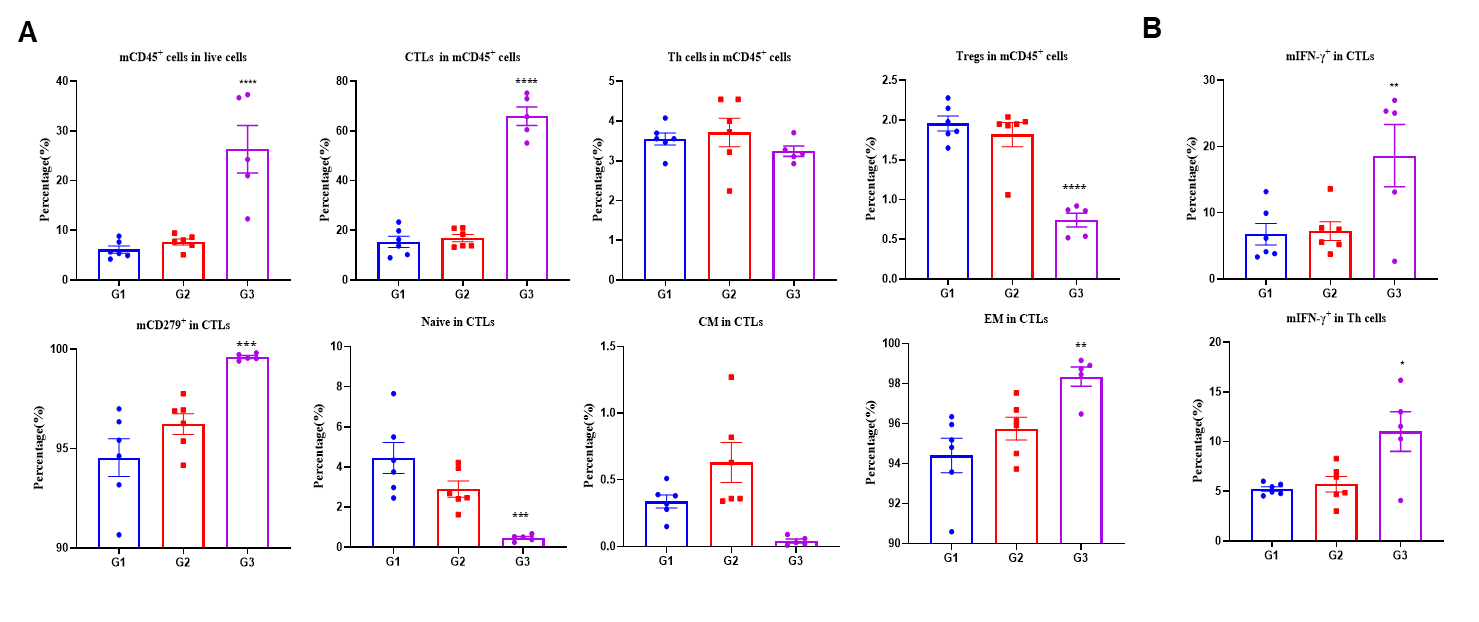
图4. LNP-mRNA增强抗肿瘤T细胞的有益库。来自接种PBS、空LNP或LNP-mRNA的B-HLA-A2.1/hNY-ESO-1 MC38肿瘤小鼠的肿瘤。(A)采用流式细胞术检测肿瘤浸润的CD8+ T细胞、CD4+ T细胞和调节性T细胞(Tregs)。结果显示,肿瘤浸润的T细胞和CD8+ T细胞在CD45+细胞中的比例显著增加,而LNP-mRNA组的Tregs比例显著下降。肿瘤内CD8+ T细胞中,初始型细胞频率明显降低,效应记忆型CD8+ T细胞显著增加。(B)从免疫小鼠肿瘤组织中分离的肿瘤浸润淋巴细胞(TILs)经NY-ESO-1肽刺激后进行胞内细胞因子染色分析。CD8+和CD4+ T细胞均能产生IFN-γ。数据以均值±SEM表示。统计分析使用单因素方差分析(ANOVA)和Dunnett的多重比较测试,对每个治疗组与G1组进行比较。*p<0.05, **p<0.01, ***p<0.001, ****p<0.0001。
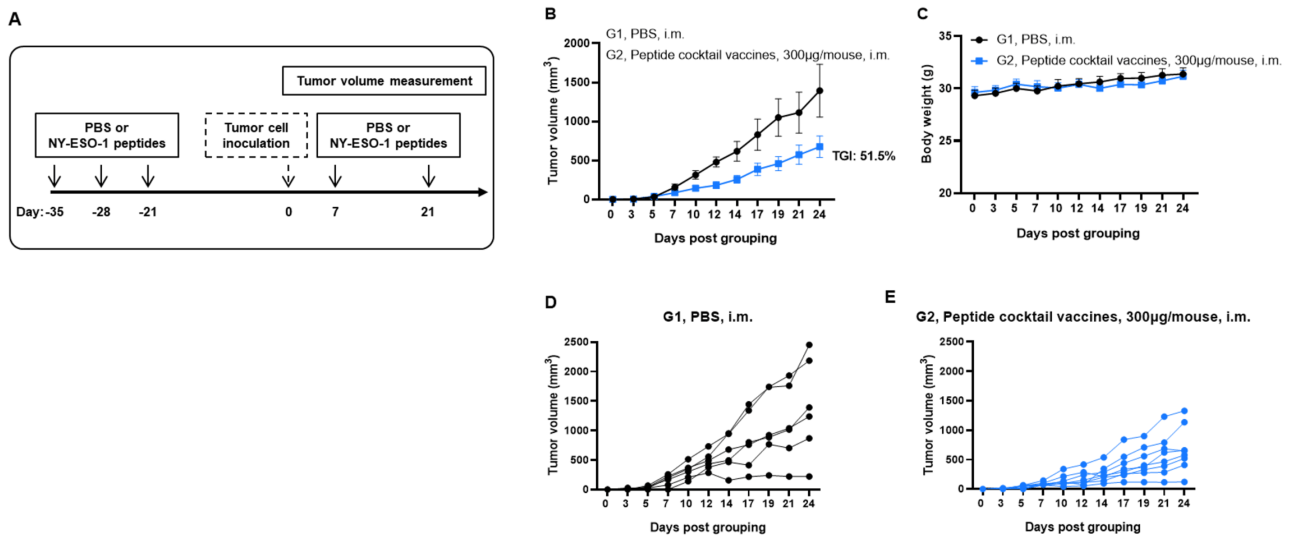
图1. NY-ESO-1肽对同种异体肿瘤的抗肿瘤活性。(A)实验方案。(B)预防性治疗NY-ESO-1肽的抗肿瘤活性。B-HLA-A2.1小鼠(n = 6或8/组)接种PBS或NY-ESO-1肽(300 µg)。最后一次免疫后三周,将B-HLA-A2.1/hNY-ESO-1 MC38细胞接种到小鼠右侧腹部。(C)治疗过程中的体重变化。如图B所示,NY-ESO-1肽在B-HLA-A2.1小鼠中有效控制肿瘤生长。(D和E)个别小鼠的肿瘤生长曲线。数据以均值±SEM表示。
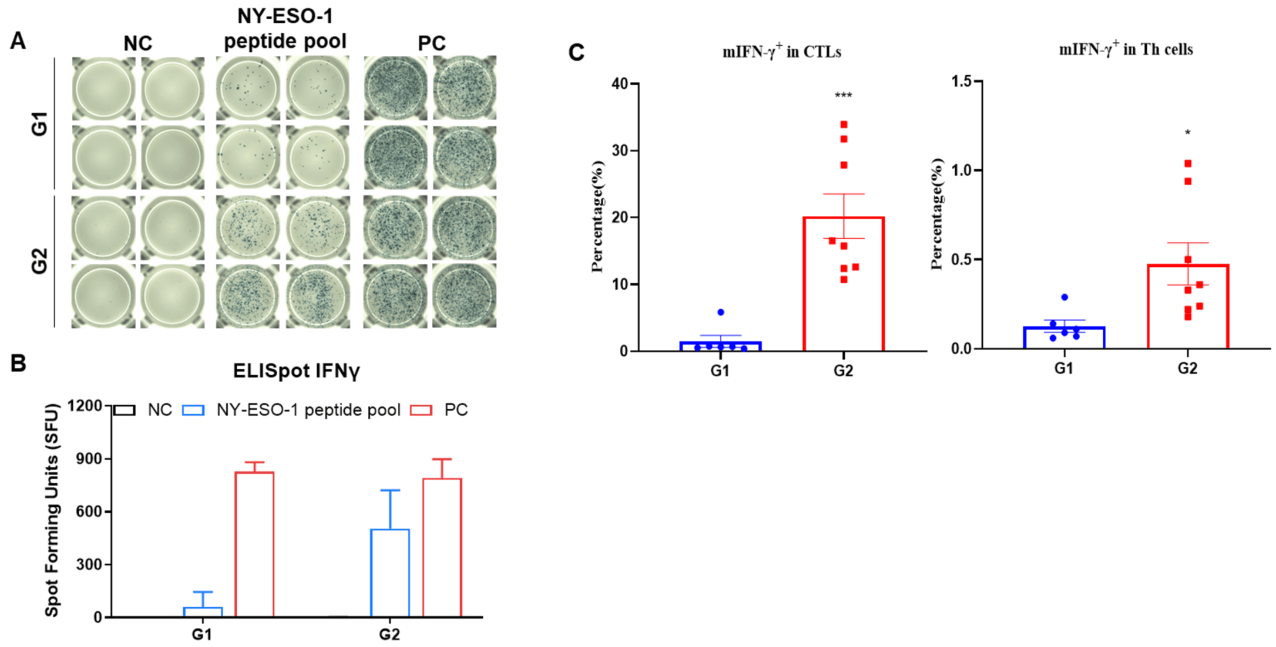
图2.(A)代表性结果展示了从免疫小鼠脾脏中分离的脾细胞,用阴性对照或肽疫苗刺激的重复检测结果。(B)结果总结。(C)mIFN-γ主要由CD8+ T细胞分泌,而不是CD4+ T细胞。数据以均值±SEM表示。统计显著性通过T检验确定。(*p<0.05, ***p<0.001 与G1组比较)。

图3. 多肽疫苗接种后在脾脏中产生特异性效应CD8+ T细胞。从接种了PBS和肽疫苗的B-HLA-A2.1/hNY-ESO-1 MC38肿瘤小鼠中取出的脾脏。通过流式细胞术分析脾脏中的CD8+T、CD4+ T和Tregs。脾脏T细胞和CD8+T细胞的百分比(CD45+细胞中的百分比)显著升高。多肽疫苗诱导的四聚体阳性CD8+ T细胞占脾脏总CD8+ T细胞的比例约为20%。CD8+ T细胞在初始和中央记忆中的比例明显较低,主要定位于效应记忆细胞中。数值以均值±SEM表示。统计学显著性通过T检验确定。*p<0.05,**p<0.01,***p<0.001,****p<0.0001与G1组相比。
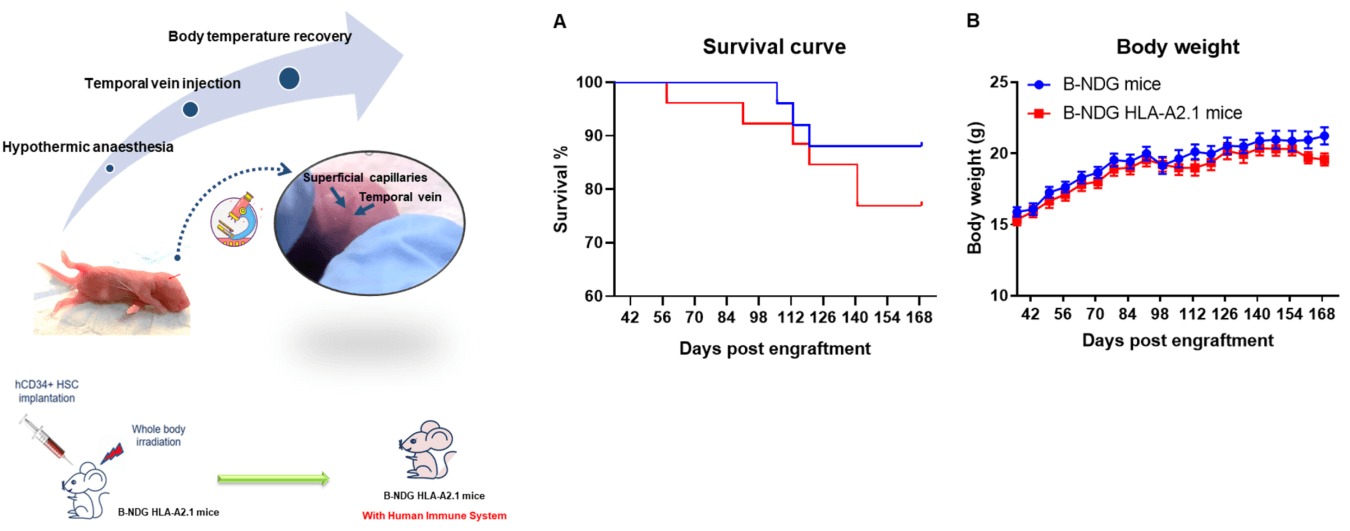
图1. 人CD34+ HSCs在B-NDG HLA-A2.1小鼠重建成功。人CD34+ HSCs分别在经过0.8 Gy辐射的B-NDG HLA-A2.1小鼠和B-NDG小鼠的出生小鼠中植入。(A) B-NDG HLA-A2.1小鼠显示出略低于B-NDG小鼠的存活率,但没有统计学显著差异。(B) 体重。数值以均值±SEM表示。
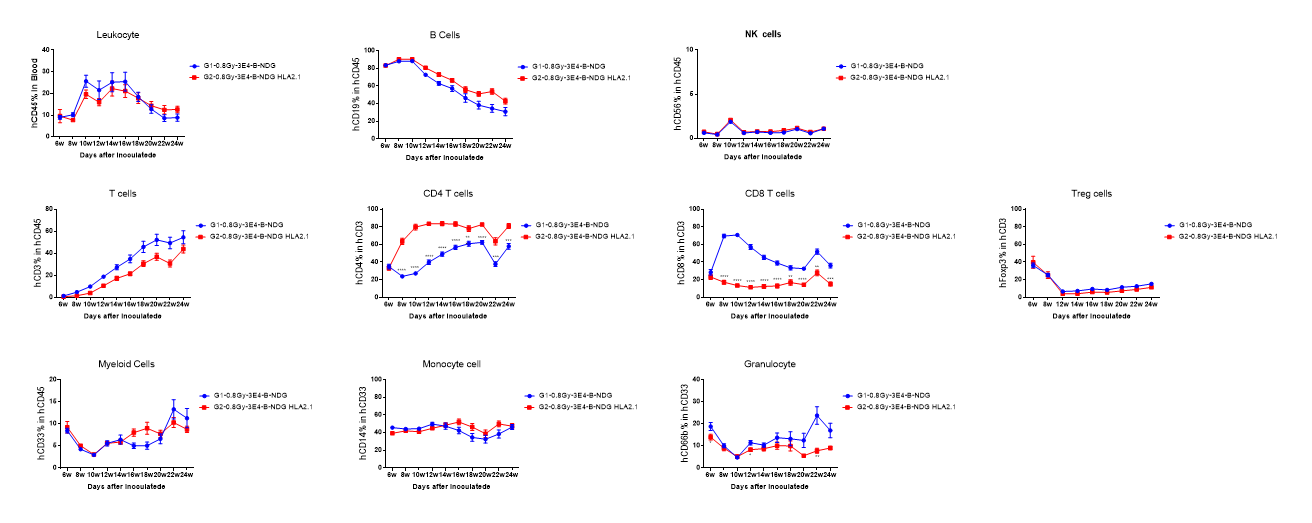
图2. 人CD34+ HSCs在B-NDG HLA-A2.1小鼠重建成功。人CD34+ HSCs分别在经过0.8 Gy辐射的B-NDG HLA-A2.1小鼠和B-NDG小鼠的出生小鼠中植入。通过流式细胞术分析人白细胞。结果显示,尽管B-NDG HLA-A2.1小鼠中hCD8+ T细胞的比例明显低于B-NDG小鼠,但在重建后的24周内保持在约18%。B-NDG HLA-A2.1小鼠中hCD4+ T细胞的比例显著高于B-NDG小鼠。B-NDG HLA-A2.1小鼠中其他重建细胞类型的比例与B-NDG小鼠相似。数值以均值±SEM表示。使用t检验对每个处理组与G1组进行比较。*p<0.05,**p<0.01,***p<0.001,****p<0.0001。
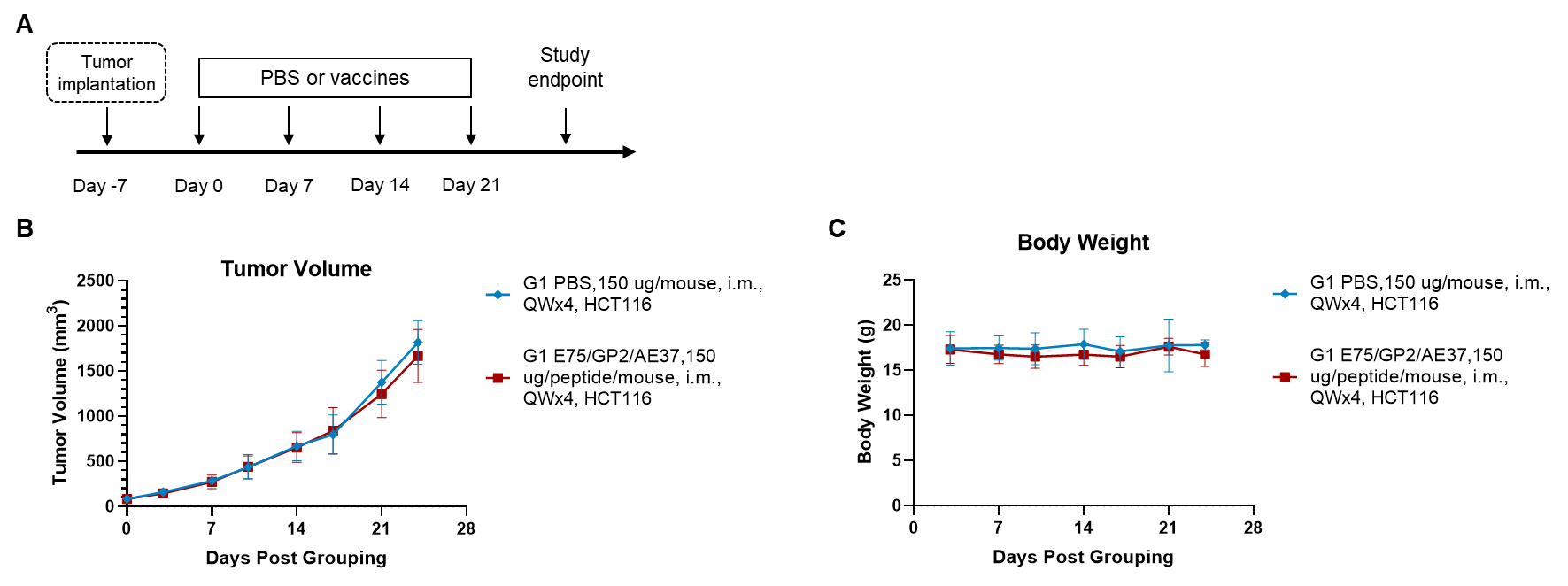
图1. 多肽疫苗在异种移植肿瘤中的抗肿瘤活性。(A) 实验方案。(B) 预防性治疗中多肽疫苗的抗肿瘤活性。将HCT-8细胞接种到B-NDG hB2M/HLA-A2.1小鼠(HSC重建)右侧腹部。B-NDG hB2M/HLA-A2.1小鼠(HSC重建)(n = 8组)接种多肽疫苗。(C) 治疗期间体重变化。数值以均值±SEM表示。
疫苗的体外评估能力:

IFN-γ ELISpot检测脾细胞对mCD3e抗体刺激的反应

IFN-γ ELISpot检测的统计直方图和孔板视图。从C57BL/6小鼠中提取的脾细胞按密度5.00×104-2.50×105/孔接种。斑点的数量表示脾细胞在mCD3e抗体刺激下产生的IFN-γ数量,提供免疫细胞激活水平的信息。数值以均值±SEM表示。
图1. 通过mIFN-γ ELISpot检测B-HLA-A2.1小鼠多肽疫苗诱导的免疫反应。6-8周龄的雌性B-HLA-A2.1小鼠分为PBS组和肽疫苗组(n = 6),分别在双腿内侧肌肉注射PBS或疫苗。最后一次免疫一周后,处死小鼠。提取脾细胞,用单一肽段或无关肽作为阴性对照(NC)刺激,检测IFN-γ分泌和抗原特异性T细胞。(A) 实验方案。(B) 代表性结果显示从免疫小鼠获得的脾细胞经阴性对照、肽疫苗或阳性对照重复刺激后的反应。(C) 结果汇总。数值以均值±SEM表示。NC:阴性对照。PC:阳性对照
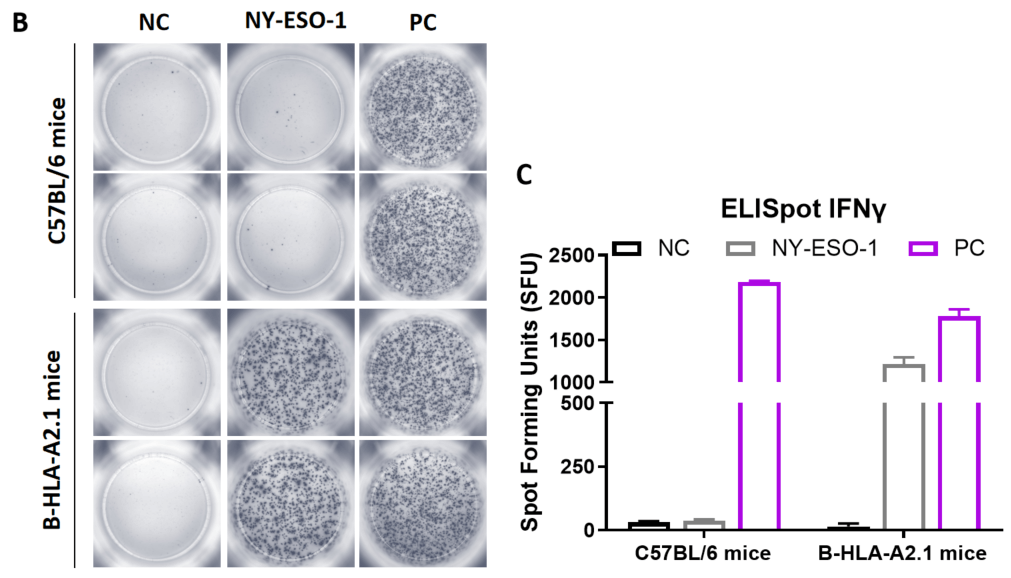
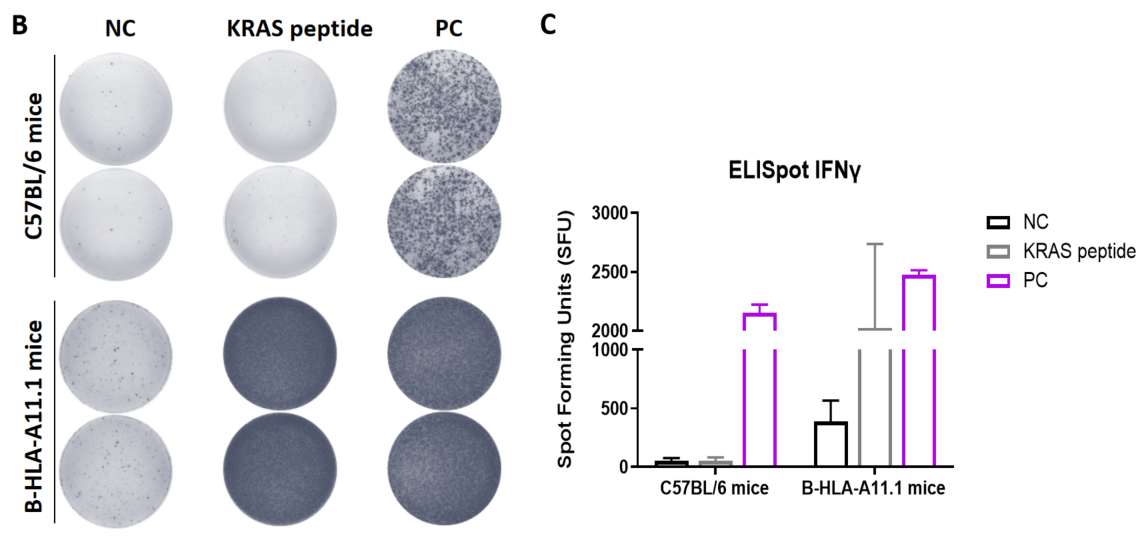
图1. 通过mIFN-γ ELISpot检测B-HLA-A11.1小鼠对多肽疫苗诱导的免疫反应。6-8周龄的雌性B-HLA-A11.1小鼠分为PBS组和肽疫苗组(n = 6),分别在双腿内侧肌肉注射PBS或疫苗。最后一次免疫后一周处死小鼠。提取脾细胞,分别用单一肽段或无关肽作为阴性对照(NC)刺激,检测IFN-γ分泌和抗原特异性T细胞。(A) 实验方案。(B) 代表性结果,显示从免疫小鼠获得的脾细胞经阴性对照、肽疫苗或阳性对照重复刺激后的反应。(C) 结果汇总。数值以均值±SEM表示。NC:阴性对照。PC:阳性对照
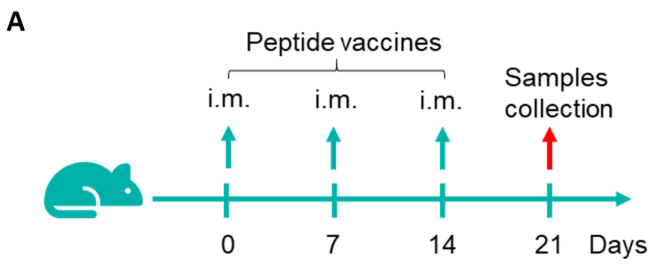
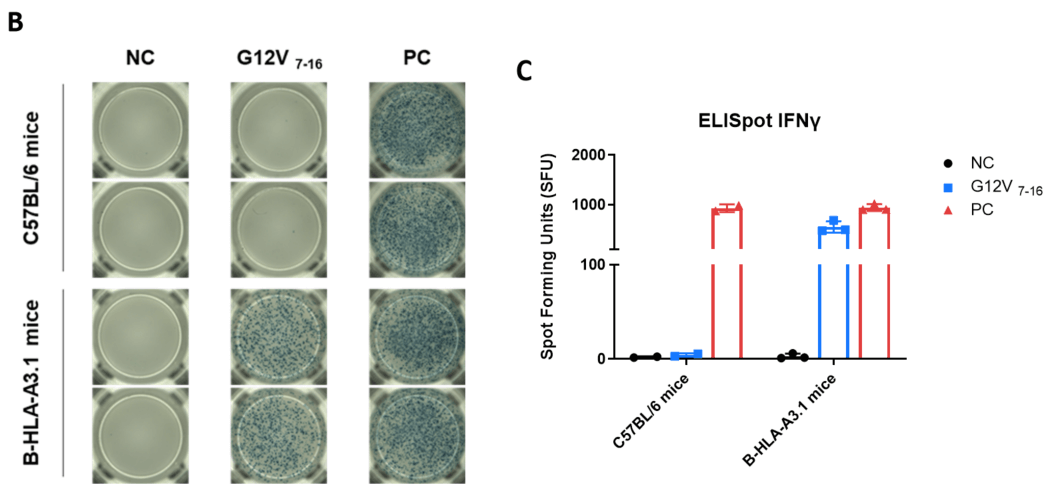
通过IFN-γ ELISpot检测B-HLA-A3.1小鼠对疫苗诱导的免疫反应。7-8周龄的雌性C57BL/6小鼠和B-HLA-A3.1小鼠分为PBS组和G12V 7-16组(n = 3),在双腿内侧肌肉注射PBS或疫苗。提取脾细胞,分别用单一肽段、无关肽(阴性对照,NC)或PMA/Ionomycin(阳性对照,PC,R&D,423302)刺激,检测IFN-γ分泌。(A) 代表性结果,显示从免疫小鼠获得的脾细胞经多肽疫苗重复刺激后的反应。(B) 结果汇总。(C) 结果汇总。数值以均值±SEM表示。