在此页面上
白喉毒素(Diphtheria Toxin, DTx)是一种由白喉棒状杆菌(Corynebacterium diphtheriae)分泌的异源二聚体外毒素,其细胞毒性依赖于通过肝素结合EGF样生长因子前体(proHB-EGF,又称DTR)介导的受体依赖性胞吞作用。DTR能结合DTx的B亚基并促进毒素进入细胞。进入细胞质后,DTx的A亚基可催化延伸因子2(EF-2)的失活,终止蛋白质合成,最终导致靶细胞凋亡死亡。
DTx诱导的细胞清除具有高度敏感性和效率——仅需一个活性A亚基分子进入细胞质即可杀死一个真核细胞。人源细胞天然对DTx敏感,而小鼠由于其HB-EGF基因存在多态性,影响DTx结合,因此对毒素不敏感。然而,通过转基因手段在人源或灵长类proHB-EGF(DTR)表达后,小鼠细胞便可获得对DTx的敏感性,构建出一种广泛适用于体内毒素诱导细胞清除的系统。
在DTR转基因小鼠中,通过组织特异性启动子或增强子驱动DTR表达,以及通过调控DTx给药方式和时间,可精准控制细胞清除的特异性与时效性。该技术为功能性剖析不同免疫细胞亚群在体内的作用提供了强大工具,尤其适用于研究癌症免疫疗法的机制,因为这些疗法常常通过多种免疫细胞介导的路径发挥作用。
百奥赛图提供一系列DTR小鼠模型,这些模型通过引入EGFP(增强型绿色荧光蛋白)和荧光素酶(Luciferase)报告基因,显著提升了实验的可视化与定量分析能力。通过这一策略,研究人员能够直观地观察在小鼠体内表达EGFP-DTR-Luciferase基因的特定细胞或组织的动态变化与功能。结合体内活体成像技术(如生物发光成像),研究人员可以在不进行创伤性操作的前提下,实时监测特定基因的表达情况及细胞活动,从而在活体状态下动态研究生理和病理过程。这种多功能整合,使得EGFP-DTR-Luciferase小鼠模型成为理解细胞功能、疾病机制以及药物作用机制的强大工具。此外,这些DTR小鼠品系在需要特异性清除某一类免疫细胞的研究中日益发挥重要作用。相较于传统单抗难以有效识别、缺乏典型表面标志的细胞群体,DTR模型提供了一种高效、精准的免疫细胞清除策略,有助于深入解析免疫系统不同亚群的功能,并优化免疫治疗反应机制的研究与开发。
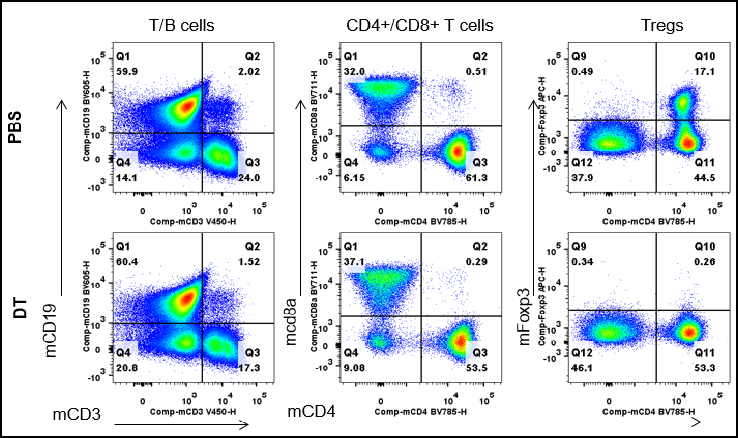
通过流式细胞术分析脾脏白细胞亚群。从雄性B-Foxp3-EGFP-DTR-Luc小鼠(n=3,7个月龄)中分离脾细胞,并注射PBS或DT(每公斤体重30ng),连续两天。通过流式细胞术分析脾细胞,评估白细胞亚群。在DT注射后,脾脏中的Tregs显著减少。
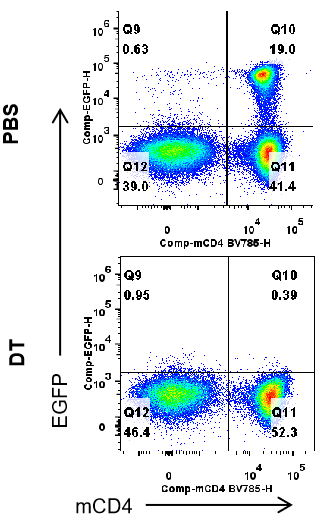
通过流式细胞术分析B-Foxp3-EGFP-DTR-Luc小鼠脾脏中的EGFP表达。从B-Foxp3-EGFP-DTR-Luc小鼠(n=3,7个月龄)中分离脾细胞,并注射PBS或DT(每公斤体重30ng),连续两天。通过流式细胞术分析T细胞中的EGFP表达。将单一存活的CD45+细胞筛选为CD3+;CD19- T细胞群体,并按此进行进一步分析。DT注射后,脾脏中的EGFP信号显著减少。
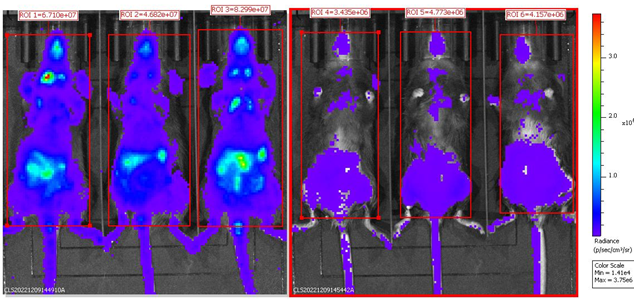
DT注射后,B-Foxp3-EGFP-DTR-Luc小鼠的BLI分析。对B-Foxp3-EGFP-DTR-Luc小鼠进行腹腔注射PBS(n=3)或DT(n=3)两天后,将小鼠麻醉并进行生物发光成像。注射150mg/kg D-Lucifenrin钾盐后10分钟,使用IVIS Lumina LT Inst Series III成像系统对小鼠进行成像。生物发光成像还可用于追踪Tregs细胞。
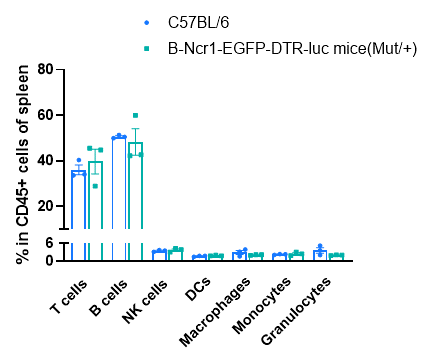
通过流式细胞术分析脾脏中白细胞亚群的频率。从C57BL/6和B-Ncr1-EGFP-DTR-Luc小鼠(n=3,9周龄)中分离脾细胞,并进行流式细胞术分析,评估白细胞亚群的频率。B-Ncr1-EGFP-DTR-Luc小鼠中的T细胞、B细胞、NK细胞、树突状细胞、粒细胞、单核细胞和巨噬细胞的百分比与C57BL/6小鼠相似。B-Ncr1-EGFP-DTR-Luc小鼠的血液和淋巴结中的白细胞亚群频率也与野生型C57BL/6小鼠相似(数据未显示)。值表示为均值±SEM。
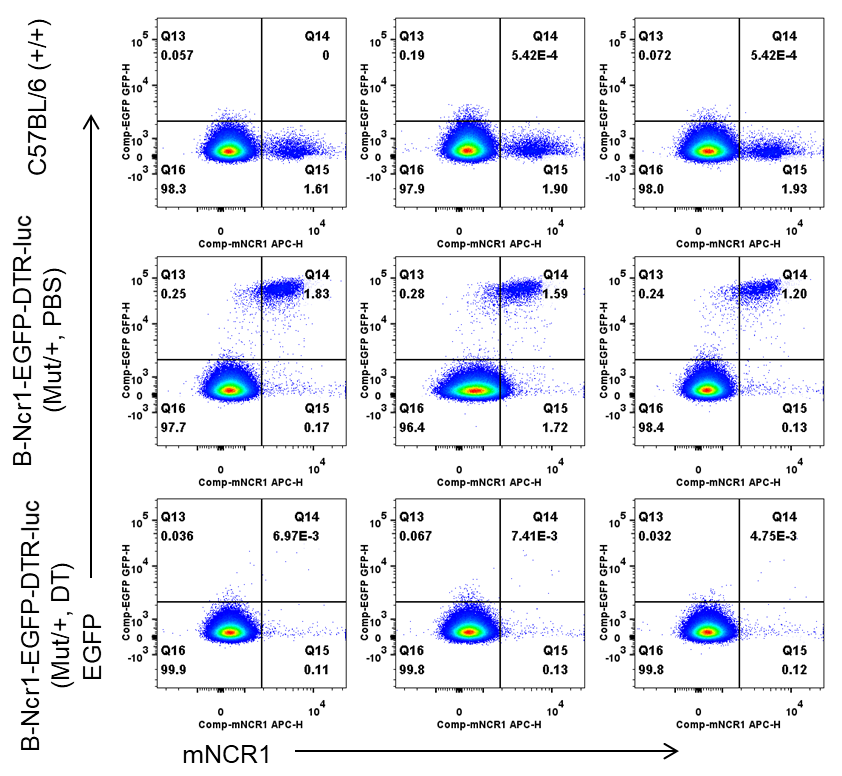
通过流式细胞术分析脾脏中NK细胞的EGFP+细胞频率。从野生型C57BL/6小鼠(+/+)和杂合B-Ncr1-EGFP-DTR-Luc小鼠(Mut/+)(n=3,8-9周龄)中分离脾细胞,注射PBS或DT(每公斤体重50ng),连续四天。通过流式细胞术分析脾细胞,评估NK细胞中EGFP+细胞的频率。注射DT后,杂合小鼠中的NK细胞中EGFP频率显著下降。