在此页面上
百奥赛图专注于开展高质量的体内药效研究,以评估新药候选物的治疗潜力。这些研究利用基因修饰的小鼠模型,重度免疫缺陷(B-NDG)小鼠及其二代小鼠,以及野生型模型,支持肿瘤学、肿瘤免疫学、自身免疫和炎症性疾病、代谢疾病和神经系统疾病的药物发现与开发。
凭借在生物药物方面的专业知识,百奥赛图提供包括单克隆和双特异性抗体、重组蛋白、ADC、肿瘤疫苗、CAR-T细胞疗法和溶瘤病毒等多种药物类型的药理药效评估服务。
我们的体内药效动物模型包括:



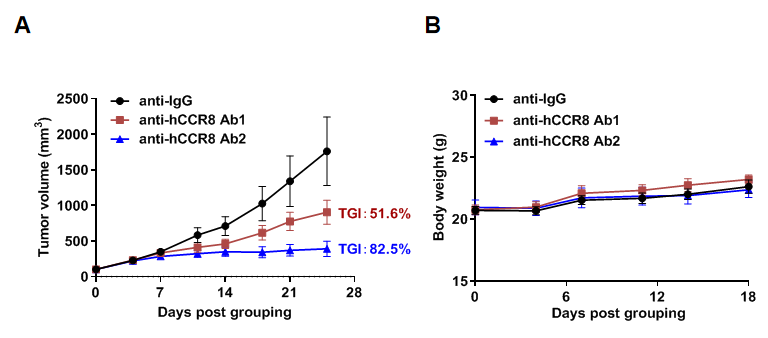
抗人CCR8抗体在B-hCCR8小鼠上对MC38细胞的抗肿瘤活性。将小鼠结肠癌MC38细胞皮下移植到B-hCCR8小鼠(雌性,7周龄,n=6)中。当肿瘤体积约为100 mm3时,将小鼠分组并给予抗人CCR8抗体(内部合成)。(A)肿瘤生长曲线。(B)治疗过程中的体重变化。如图所示,抗人CCR8抗体在B-hCCR8小鼠中有效控制了肿瘤生长。B-hCCR8小鼠为抗人CCR8抗体的体内药效评估提供了强有力的临床前模型。数值表示为均值 ± SEM。
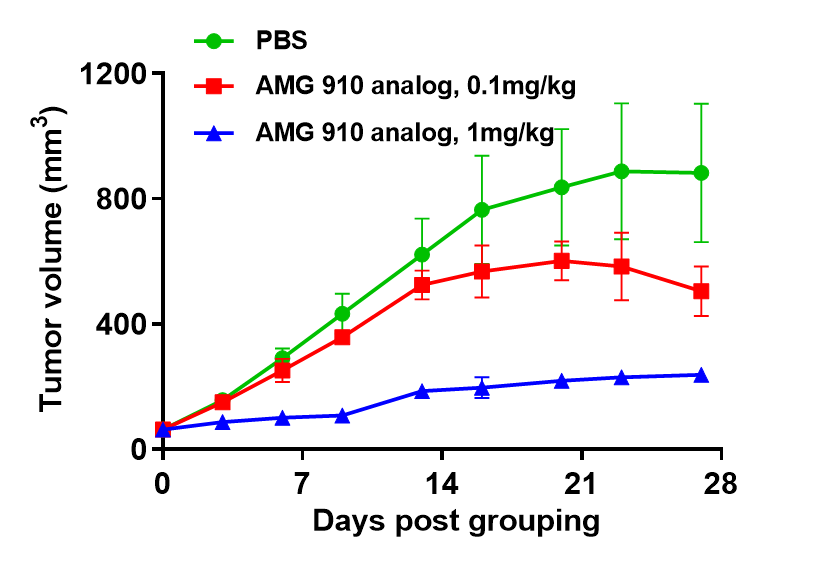
双特异性抗体在人免疫系统重建模型中的药效评估。用于CD3双特异性抗体研究的人免疫系统重建模型。将人PBMC(5E6)通过静脉注射到B-NDG小鼠后,皮下植入NUGC4肿瘤细胞(5E6)。抗人CD3×Claudin18.2双特异性抗体(AMG 910类似物)显著抑制了人PBMC重建的B-NDG小鼠中NUGC4肿瘤的生长。
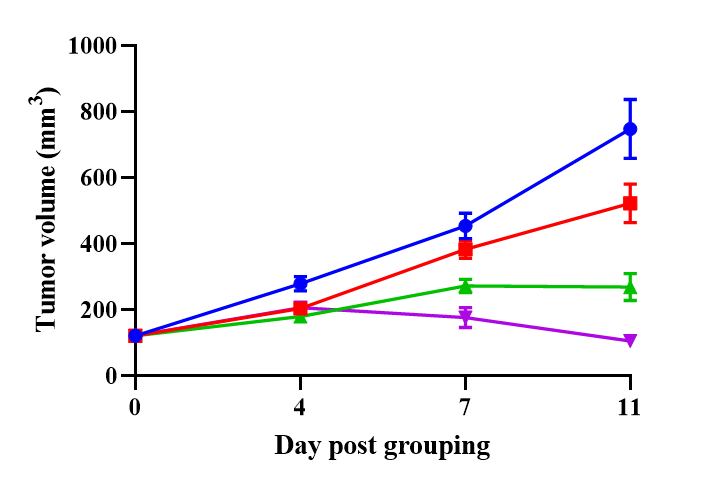
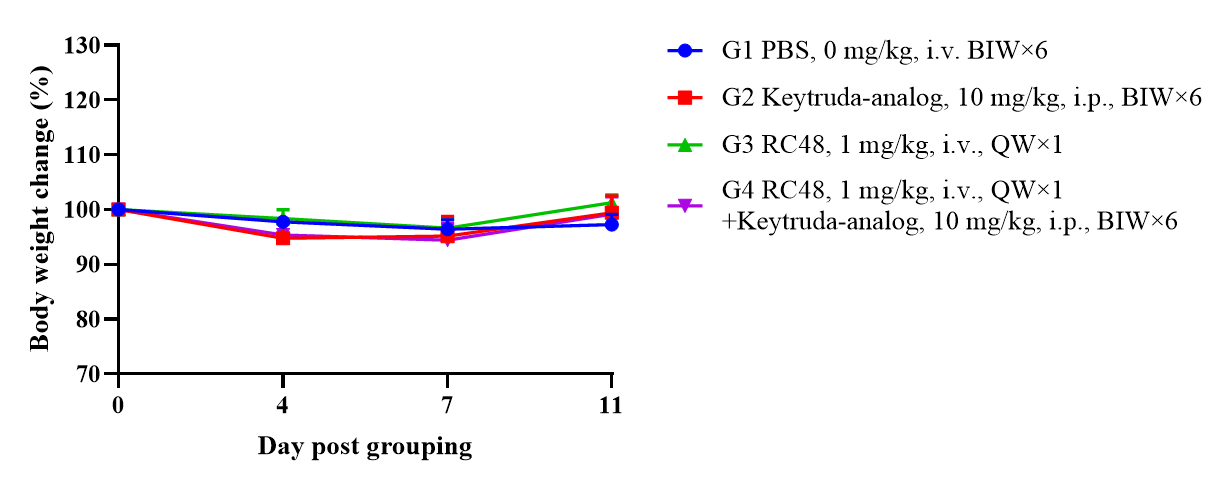
使用人PBMC重建的B-NDG小鼠进行HER2-ADC药效研究
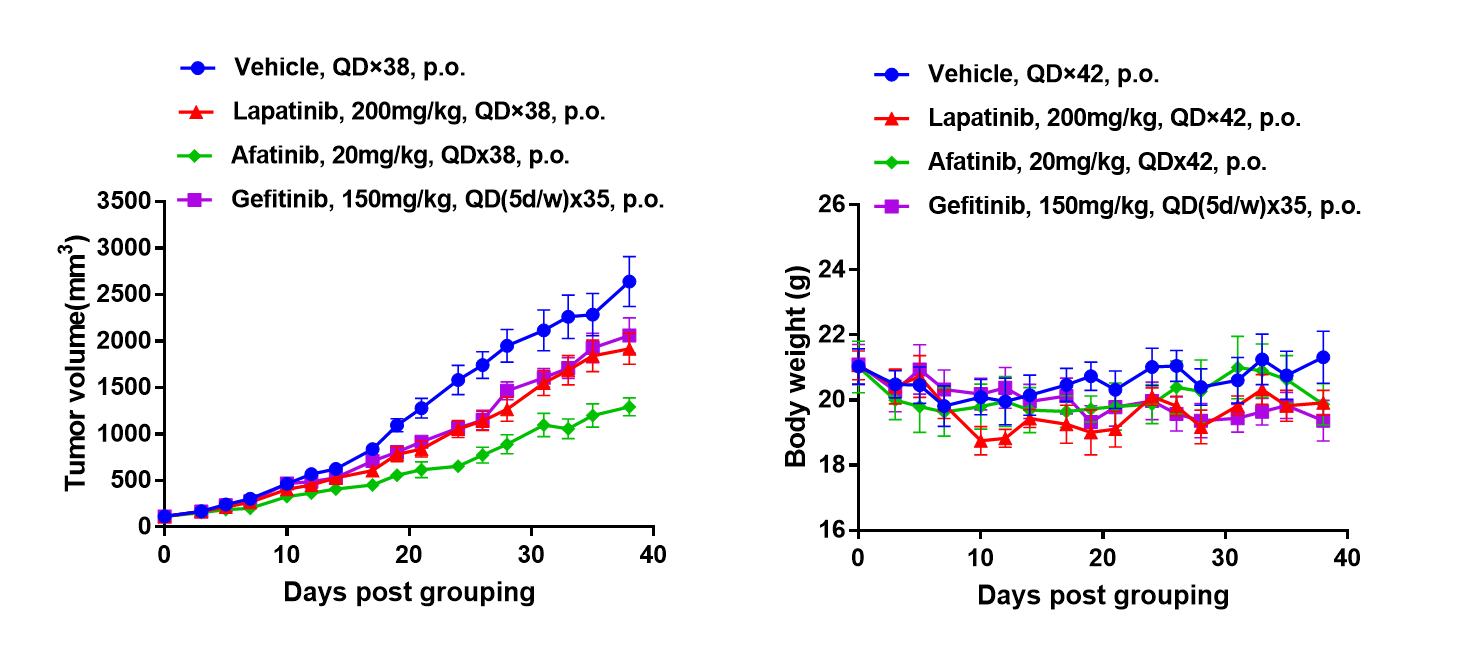
靶向EGFR的药物在B-NDG小鼠中的抗肿瘤活性。(A)靶向小分子抗肿瘤药物对BP0062在B-NDG小鼠中肿瘤生长的轻度抑制。将BP0062 PDX模型皮下移植到B-NDG小鼠(雌性,6周龄,n=6)中。当肿瘤体积约为100 mm3时,将小鼠分组并根据如图所示的不同靶向药物和方案进行治疗。(B)治疗过程中的体重变化。如图A所示,靶向小分子抗肿瘤药物有显著治疗效果,表明BP0062 PDX模型可用于建立肿瘤模型,并提供一个有力的包含EGFR阳性细胞的临床前胰腺肿瘤模型。数值表示为均值 ± SEM。
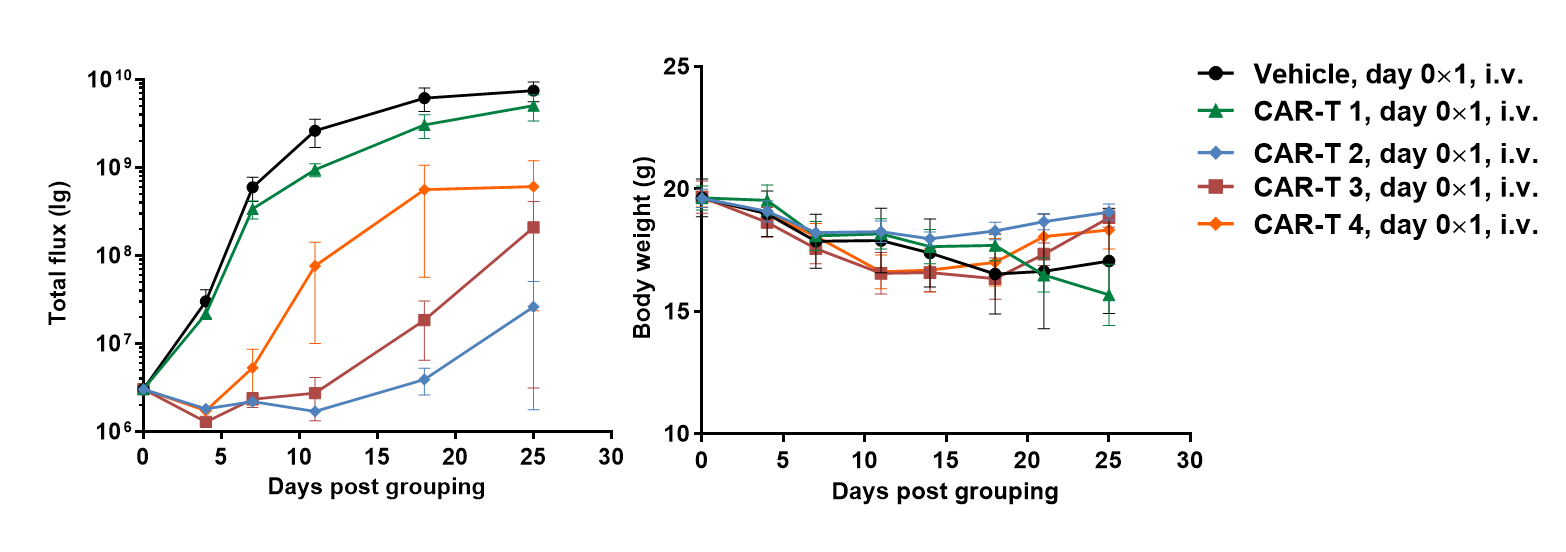
通过B-NDG小鼠建立Raji淋巴瘤小鼠模型,并验证抗人CD47抗体的药效。将B-luc-GFP Raji细胞(5×105)通过尾静脉注射到B-NDG小鼠。体内活体成像系统(IVIS)用于观察肿瘤生长。当肿瘤的荧光强度达到约1×106 p/sec时,将动物分为一个对照组和三个治疗组(n=6)。(A)肿瘤细胞的荧光强度曲线;(B)体重。结果显示,三种抗人CD47抗体均可显著抑制肿瘤生长。B-NDG小鼠是验证抗人CD47抗体药效的强有力模型。数值表示为均值 ± SEM。