在此页面上
急性肝损伤(Acute liver injury, ALI)和自身免疫性肝病(如自身免疫性肝炎Autoimmune hepatitis, AIH)是严重的疾病,如果不正确管理,可能导致肝衰竭。ALI通常由毒素、病毒感染或缺血等因素引起,导致肝细胞死亡和炎症。自身免疫性肝病,包括AIH,发生在免疫系统错误地攻击肝脏时,导致慢性炎症并可能发展为肝硬化。
为研究上述疾病状态并评估潜在治疗方法,百奥赛图已建立多种动物模型,包括对乙酰氨基酚(APAP)诱导型和刀豆球蛋白A(Concanavalin A, Con A)诱导型急性肝损伤模型。这些模型对于探索疾病机制及验证缓解肝损伤与炎症的新型治疗策略具有重要意义。
对乙酰氨基酚(APAP)在口服后2小时内被肠道吸收,通过葡萄糖醛酸化和磺化在肝脏中代谢,并随尿液排出。 一小部分 (10-15%) 在肝细胞中通过细胞色素 P450 异构体代谢为烷基化、剧毒代谢物 N-乙酰基-对苯醌亚胺 (NAPQI)。 抗氧化剂谷胱甘肽 (GSH) 将 NAPQI 转化为危害较小的还原形式,然后通过胆汁排出体外。 当谷胱甘肽耗尽时,越来越多的 NAPQI 与线粒体蛋白结合并导致肝细胞坏死。
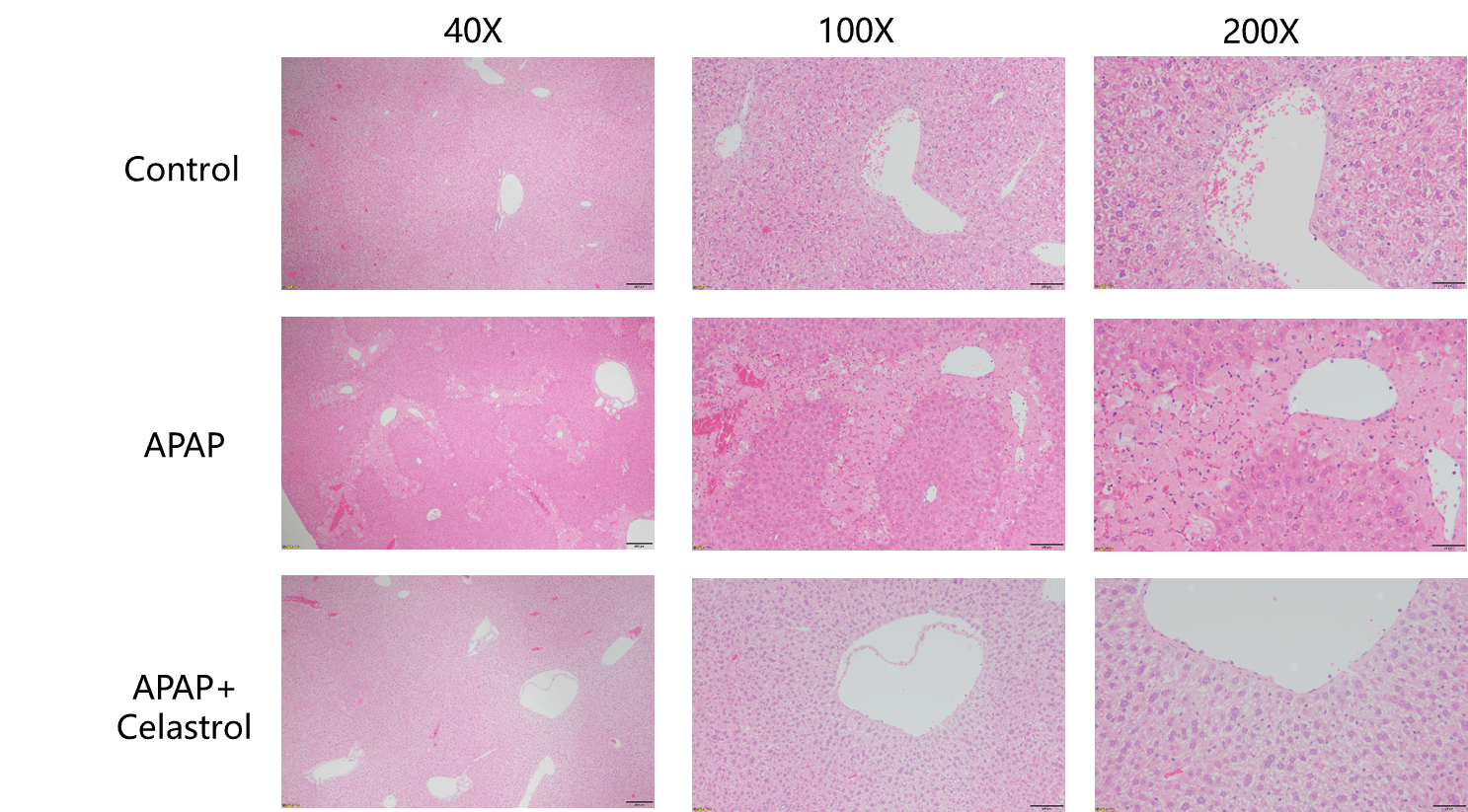
Celastrol对APAP肝损伤模型的保护作用。 模型动物的肝脏在肝小叶的边缘区显示出不同程度的凝固性坏死和细胞出血现象,Celastrol治疗组在病理学上显示了显著的改善。
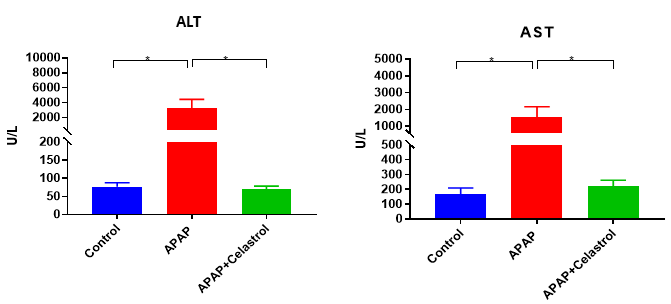
Celastrol治疗减轻了APAP诱导的ALT和AST酶活性升高。数据以均值±SEM表示。每组N = 8只小鼠。*p<0.05。
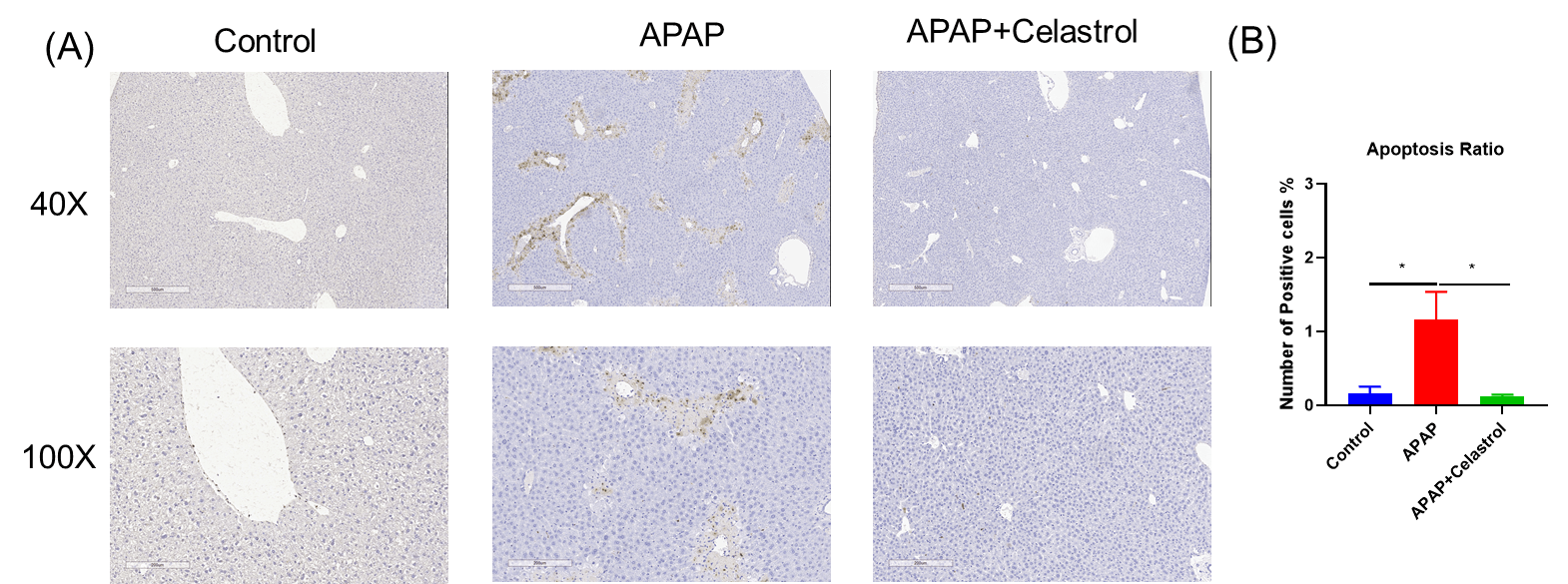
Celastrol减少了APAP诱导的肝损伤中的细胞凋亡。 A, TUNEL染色显示肝细胞中的凋亡情况。B, TUNEL阳性染色的统计数据。数据以均值±SEM表示。每组N = 8只小鼠。*p<0.05。
ConA诱导的小鼠肝炎模型中的发病机制和病理变化,其中肝损伤由T细胞和巨噬细胞激活介导,部分模仿了人类自身免疫性肝炎的特征,因此该模型广泛用于研究疾病的发病机制、病理变化以及临床治疗。肝细胞凋亡、坏死和白细胞浸润是免疫性肝炎的显著特征。在该模型中,活化的T细胞和巨噬细胞浸润到肝组织间质,并引发多种促炎因子(如TNF-α、IFN-γ、IL-1β和IL-2)的分泌。
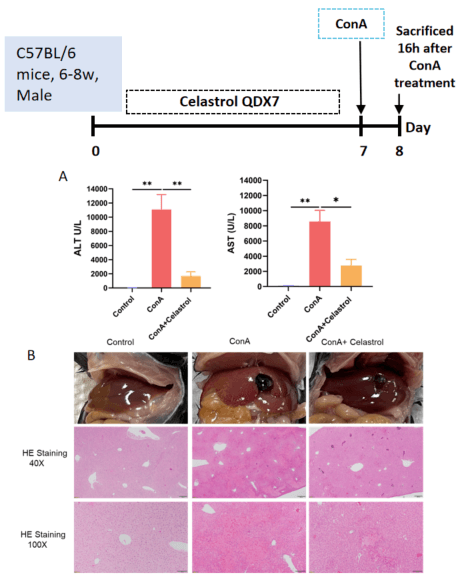
A, Celastrol治疗减轻了ConA诱导的ALT和AST酶活性升高。B, H&E染色分析了Celastrol在ConA诱导NASH小鼠模型中的保护作用。数据以均值±SEM表示。每组N = 8只小鼠。*p<0.05,**p<0.01。
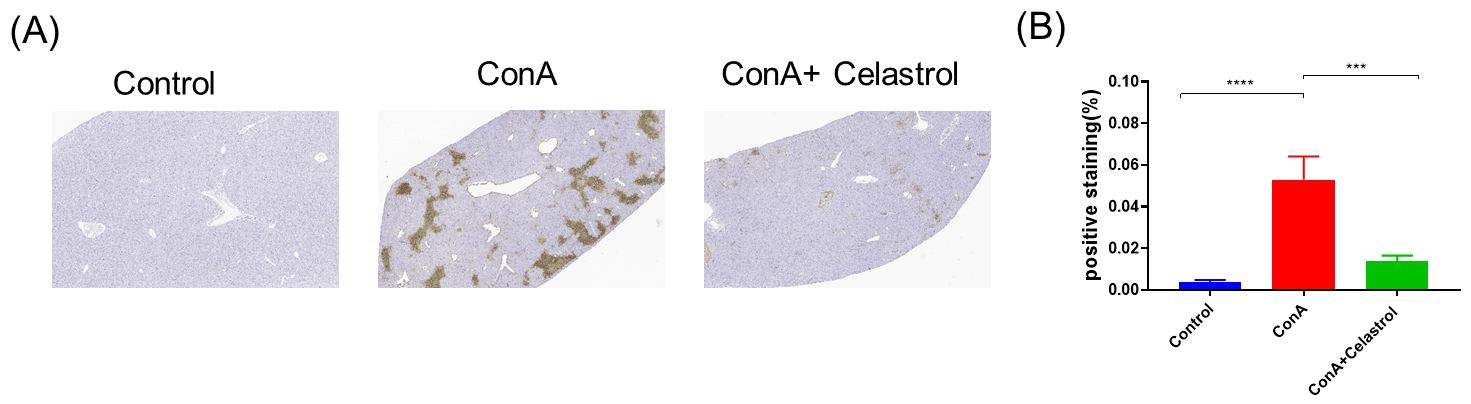
Celastrol在ConA诱导急性肝损伤小鼠模型中的保护作用病理学分析。 A, TUNEL染色显示肝细胞中的凋亡情况。B, TUNEL阳性染色的统计数据分析。数据以均值±SEM表示。每组N = 8只小鼠。***p<0.001。
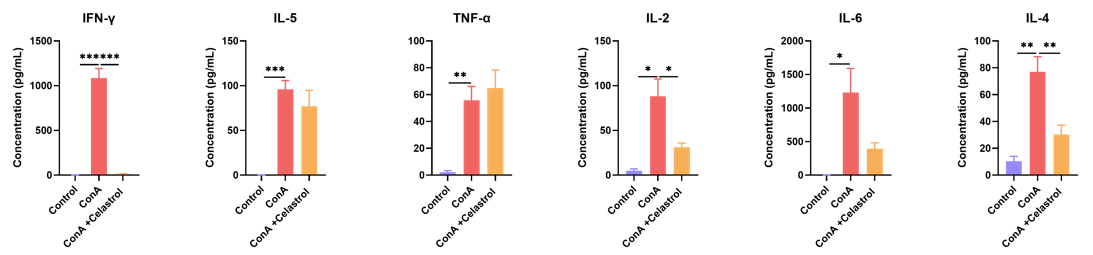
Celastrol治疗减轻了ConA诱导急性肝损伤模型的细胞因子水平升高。每组N = 8只小鼠。*p<0.05。