在此页面上
百奥赛图的专业技术团队和销售人员致力于帮助研究人员实现他们的动物模型需求。我们定制模型所采用的基因编辑策略包括:
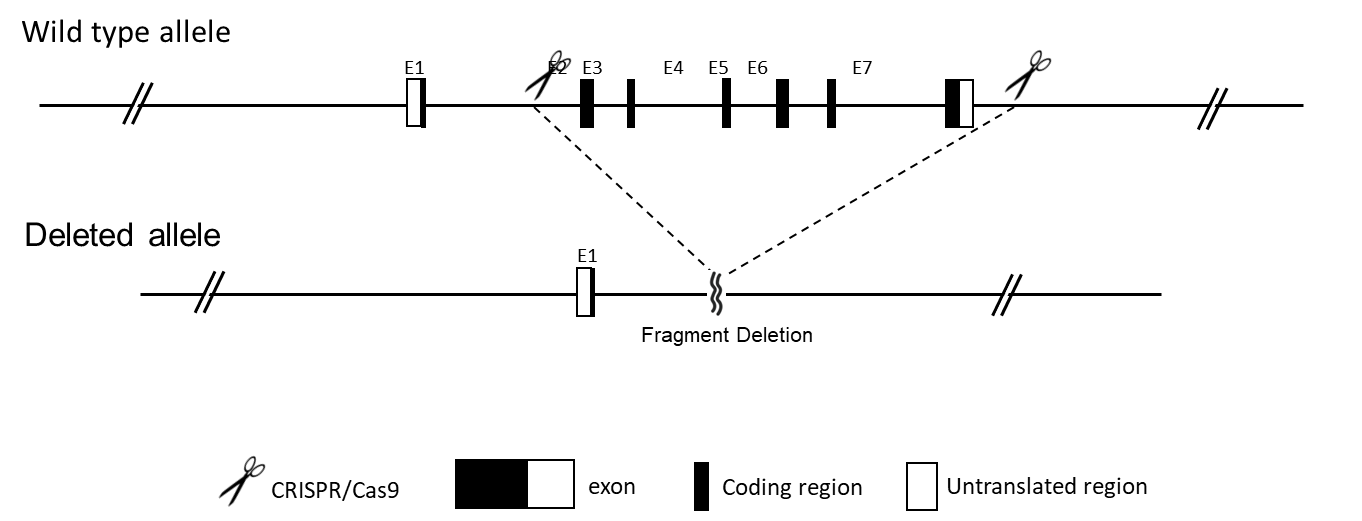
在全身基因敲除(KO)小鼠模型中,目标基因的外显子会被整体删除(EGE™方法)或用阳性选择标记(大多数情况下为新霉素)替换,从而使该基因失活。在全身敲除小鼠中,目标基因在所有组织中均被破坏。
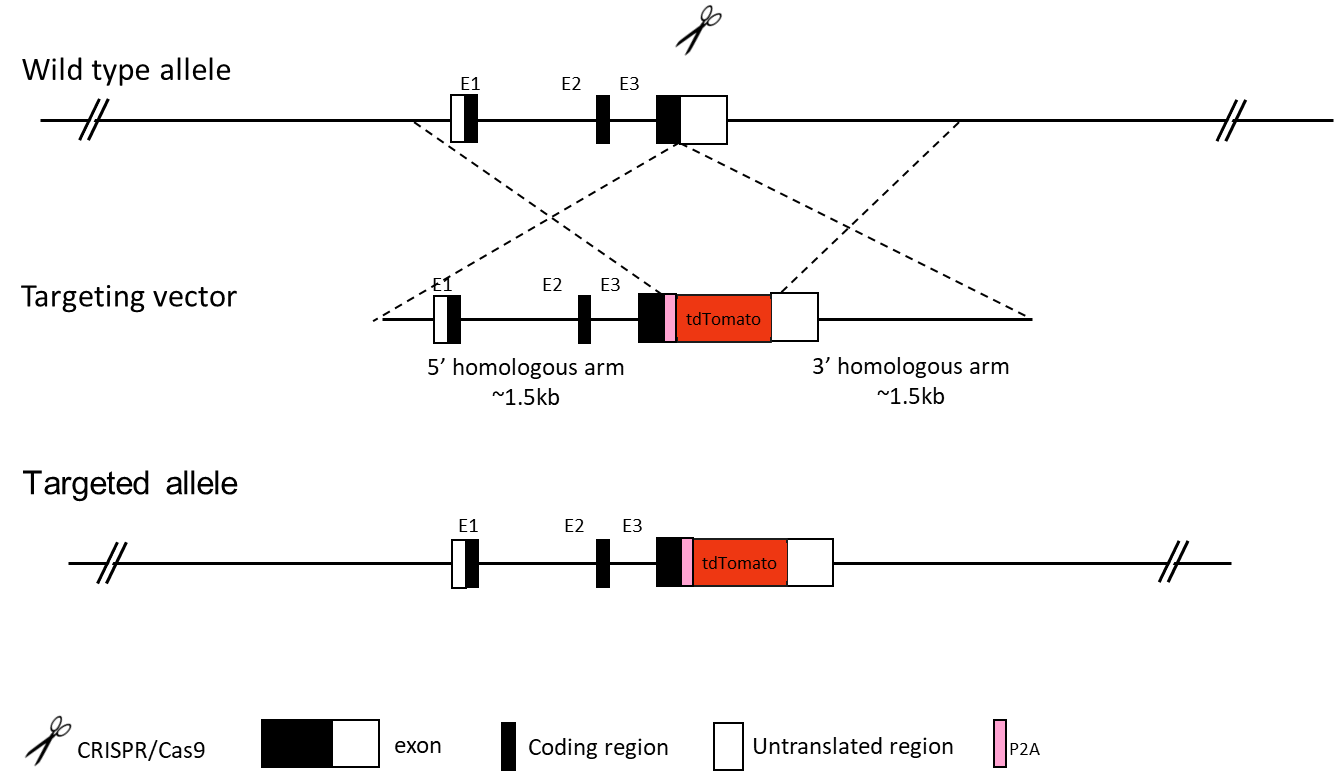
全身性基因敲入小鼠模型将突变或外源DNA序列整合至小鼠基因组的特定位点。这些模型可以模拟基因突变引起的人类遗传性疾病,或者在基因与不同蛋白标签(如EGFP、mRFP、mCherry、YFP、LacZ和Flag)标记时进行基因表达监测。
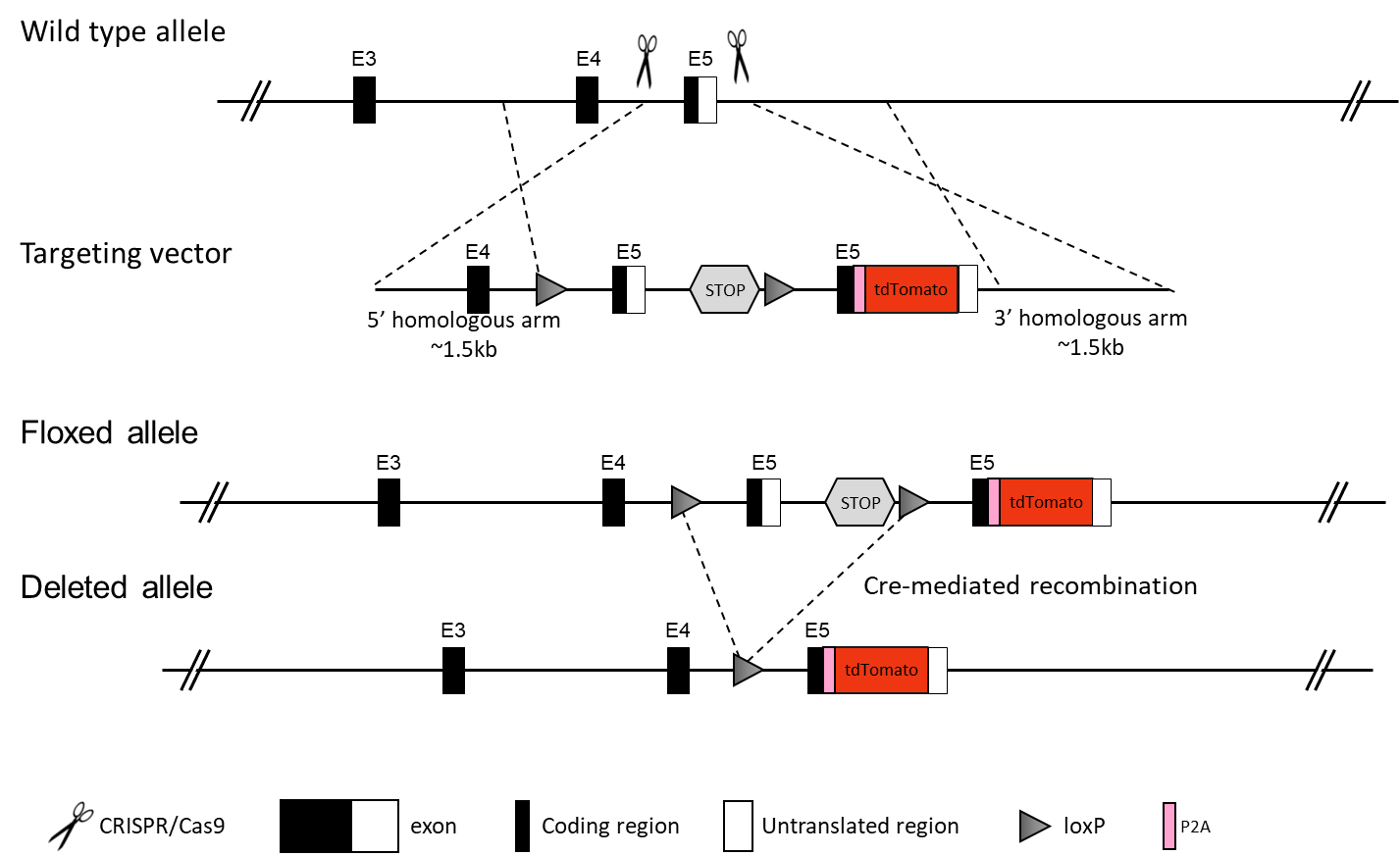
条件性敲除(cKO)模型通过 Cre-LoxP/Flp-Frt 重组系统构建。待敲除的靶片段两侧会插入 LoxP(或 Frt)元件,随后将该 “loxP 位点修饰小鼠”(Floxed 小鼠)与组织特异性 Cre 小鼠或 Flp 小鼠进行杂交 —— 使子代基因组中 LoxP 位点之间的序列以组织特异性模式被删除。在典型设计中,Cre 小鼠仅在靶组织中启动重组反应。LoxP 片段通常插入含 ATG 起始密码子的外显子下游的内含子中,删除两侧翼外显子后会导致移码突变,进而阻断蛋白质表达。

条件性敲入(cKI)小鼠模型可实现外源性遗传元件(如点突变、报告基因或功能表达盒)的组织特异性激活 —— 通过将携带 loxP 位点修饰等位基因(floxed 等位基因)的小鼠与组织特异性或诱导性 Cre 小鼠(或 CreERT2 小鼠)进行杂交,确保仅在 Cre 重组酶存在的部位启动激活。此类模型通常采用 FLEx(翻转 - 切除 / 双 lox 位点)系统或基于迷你基因的设计构建,使工程化突变或报告基因能够以空间和 / 或时间调控的方式表达。这种由 Cre-lox 系统介导的条件性敲入策略,被广泛应用于基因调控研究、谱系示踪及细胞类型特异性生物学功能解析。
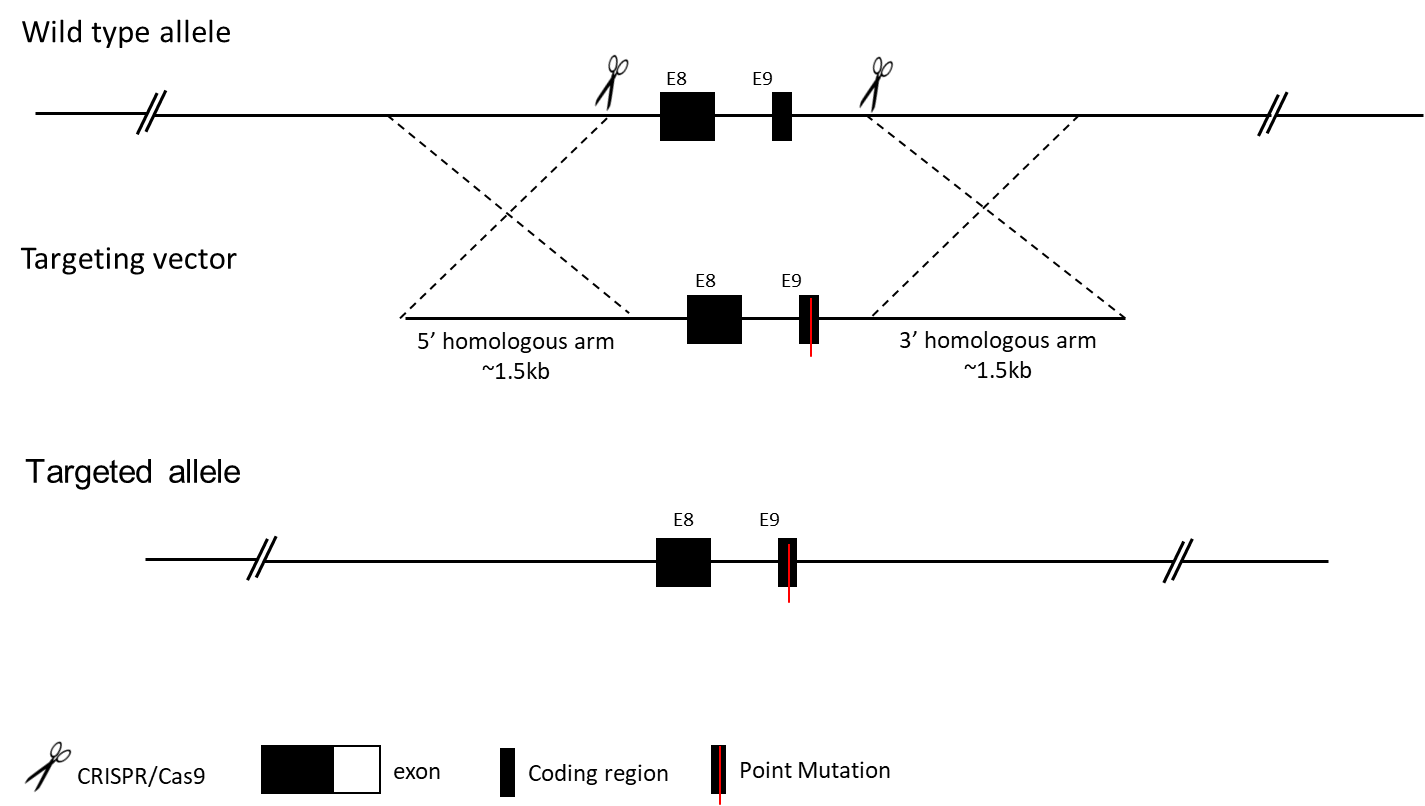
传统点突变小鼠模型是一种基因敲入品系,其基因组中的一个或多个核苷酸被变异核苷酸所替换。该突变导致给定蛋白质序列内的氨基酸置换,或移码突变。这类点突变敲入模型被广泛用于研究特定核苷酸或氨基酸在蛋白质中的作用,为人类遗传性疾病研究提供直接参考。
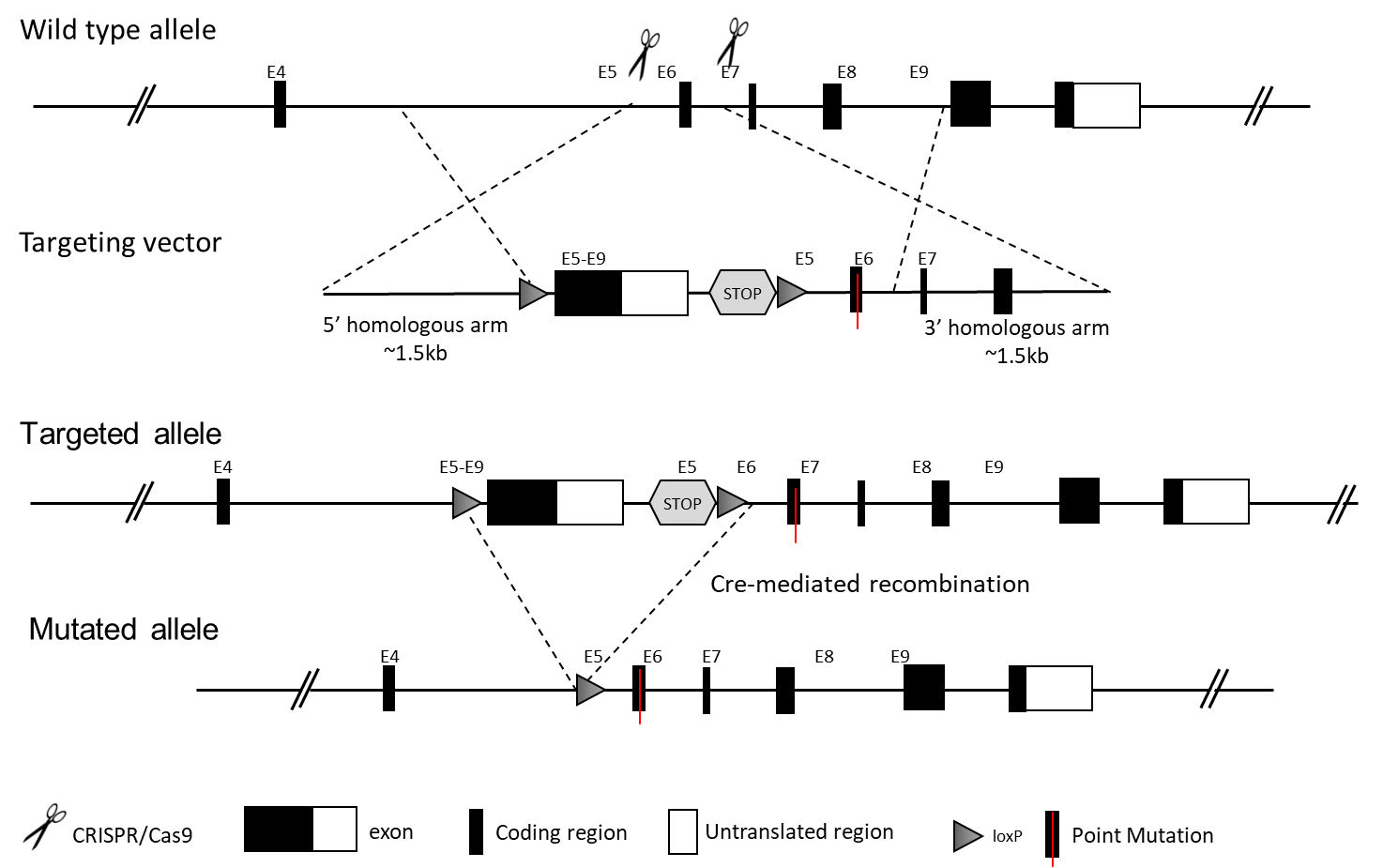
条件性点突变小鼠模型在满足特定条件时引入点突变。在下面的基因靶向策略中,当Cre重组酶存在时,点突变将通过Cre活性在组织特异性地引入。以下示出了两种主要的设计策略。
传统转基因小鼠模型通过原核显微注射质粒构建,可获得多个不同基因组整合位点的首建鼠(Founder)。由于外源基因整合拷贝数及位点的差异,不同首建鼠的实验结果可能存在变异且难以重复。目前,研究者普遍采用位点特异性整合策略构建基因编辑小鼠模型。其中,Rosa26是最常用的"安全港"位点,因其编码的是一个在几乎所有组织中均表达的非必需核RNA。通过在Rosa26位点外源序列上游插入LoxP-3XSTOP-LoxP序列,并与Cre工具鼠交配,即可实现外源基因的条件性表达。其他常见安全港位点还包括H11和TIGRE。
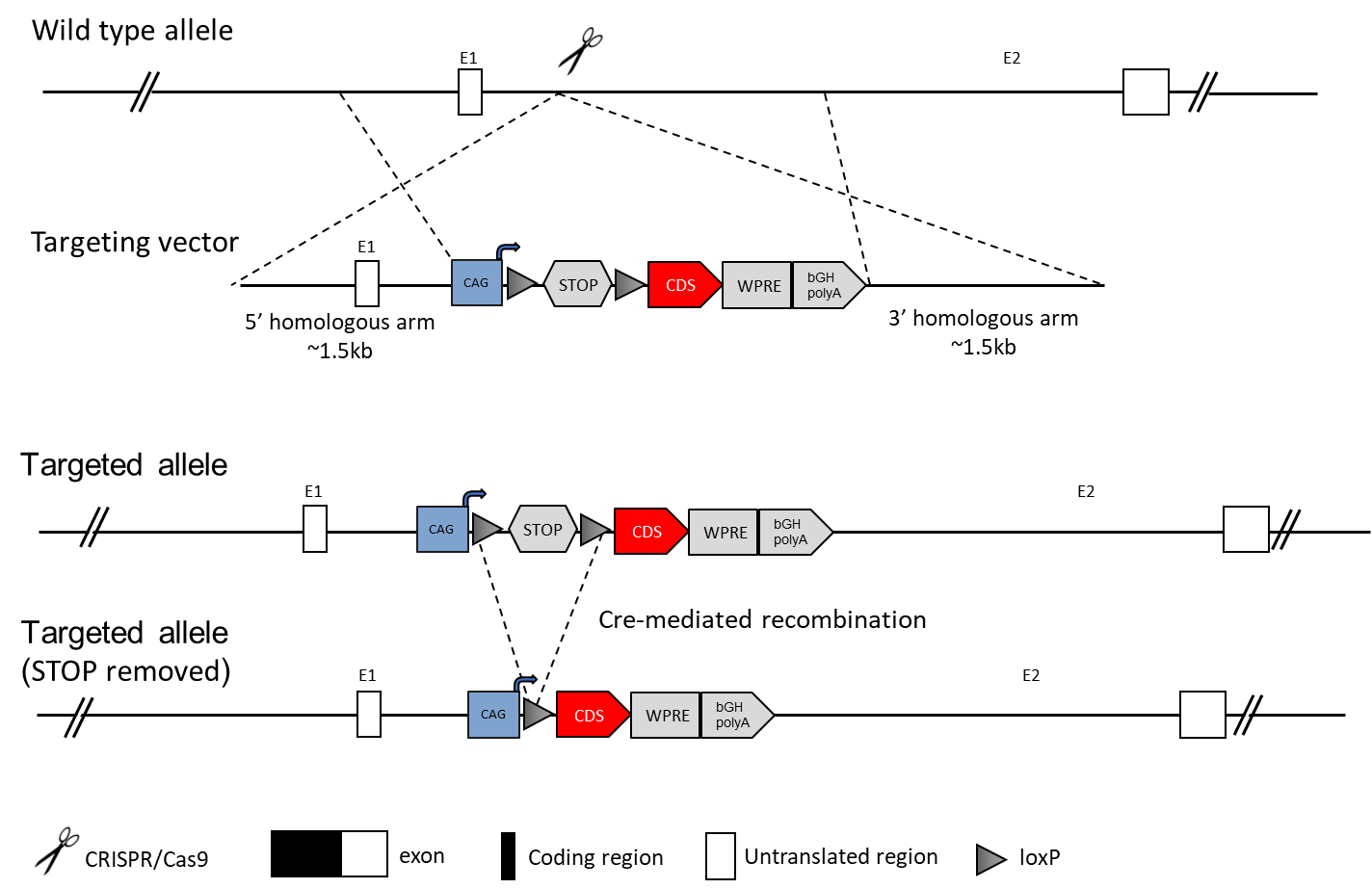
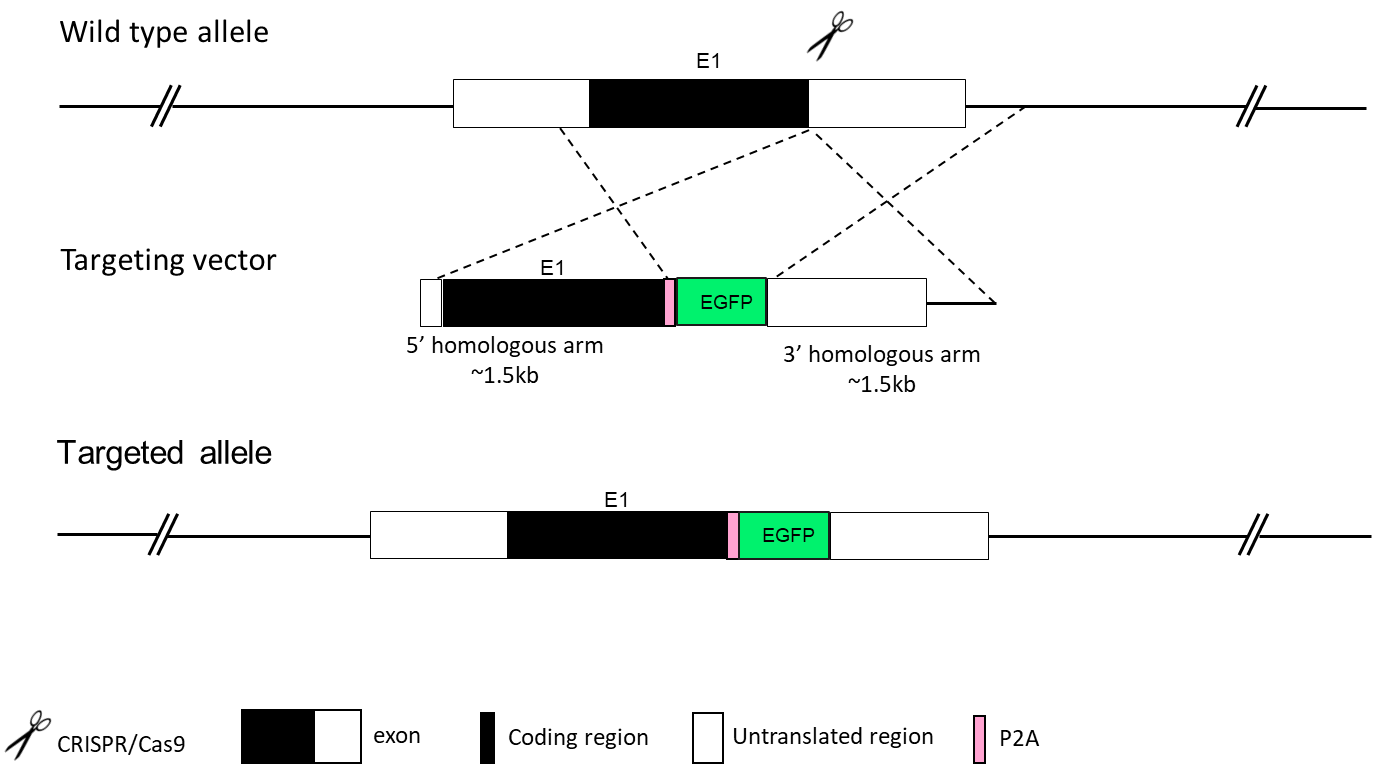
基因被EGFP、YFP、LacZ、Flag、mCherry等标签标记,便于监测基因表达。告基因小鼠模型可用于构建细胞发育谱系,同时通过内源基因替换策略,可在同一模型中实现基因敲除与敲入的双重目的。
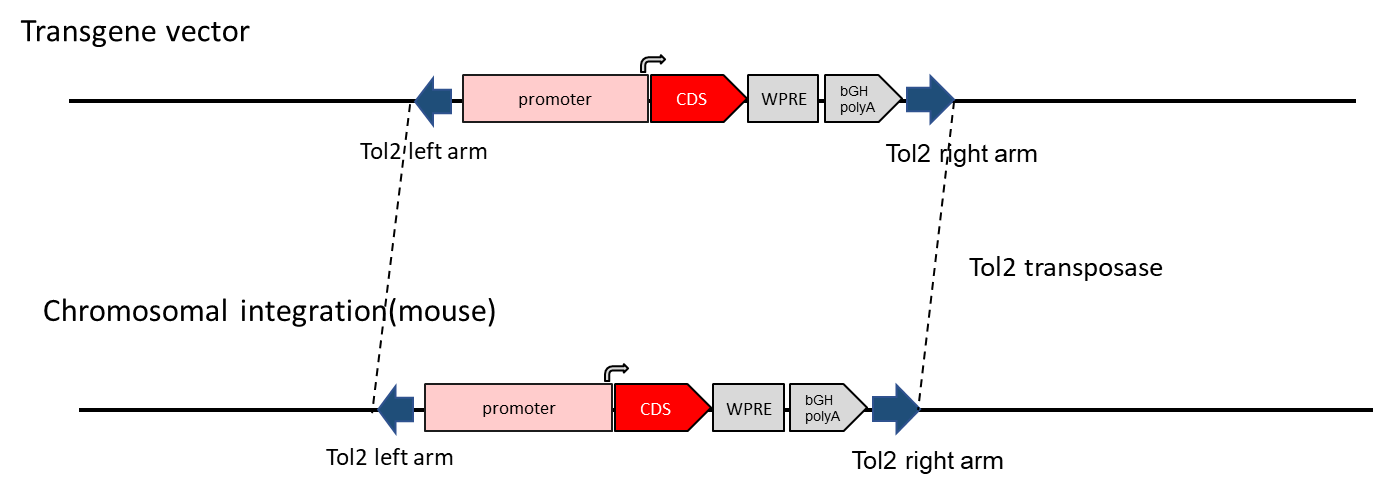
Tol2小鼠模型利用Tol2转座酶活性构建转基因小鼠。Tol2转座子系统不仅能提高基因整合率,还倾向于将外源基因整合到AT丰富的区域。
百奥赛图结合生物信息学分析方法,通过搜索目标基因组中与sgRNA相似的序列区域来降低脱靶效应。因此,只选择具有高特异性和高活性的sgRNA。作为质量控制措施的一部分,我们可以执行两轮PCR,以扩增潜在脱靶位点周边的基因组区域,然后通过测序检测脱靶事件。我们还将Southern blot整合到我们的工作流程中,作为检测敲入和条件性敲除动物模型构建的重要质量控制步骤,以检测任何潜在的随机插入。项目启动后,我们将为您配备专属项目经理,定期(每月)汇报模型构建进展,并提供全天候技术咨询支持。

获取有关我们基因编辑服务技术的更详细信息,请下载基因编辑手册。