在此页面上
全基因组人源化小鼠模型因其卓越的跨场景适应性,正成为人源化研究领域的优先选择。这些模型不仅表现出更接近人类的基因表达,取得了更高的成功率,更对小核酸药物的药效学研究至关重要。
众多基因跨度较大,超过100kb-200kb。采用受精卵CRISPR技术(最大编辑能力≤20kb)或胚胎干细胞重组技术(最大编辑能力≤30kb)靶向修饰此类基因存在显著技术瓶颈。
尽管BAC转基因技术可实现200kb以上大片段人源基因向小鼠基因组的转移,但这些小鼠并未消除鼠源同源基因,并且需要较长周期来构建品系,无法匹配科学研究日益增长的需求。
百奥赛图开发的胚胎干细胞EGE技术(EGES)整合CRISPR-Cas9和小鼠胚胎干细胞(ES细胞),实现了靶向超长DNA片段。它有效结合了小鼠胚胎干细胞中的大片段同源重组能力,并通过CRISPR/Cas9诱导DNA双链断裂后的高效修复机制。
目前,该技术已成功靶向约150 kb的基因片段,我们正在努力突破到170 kb。
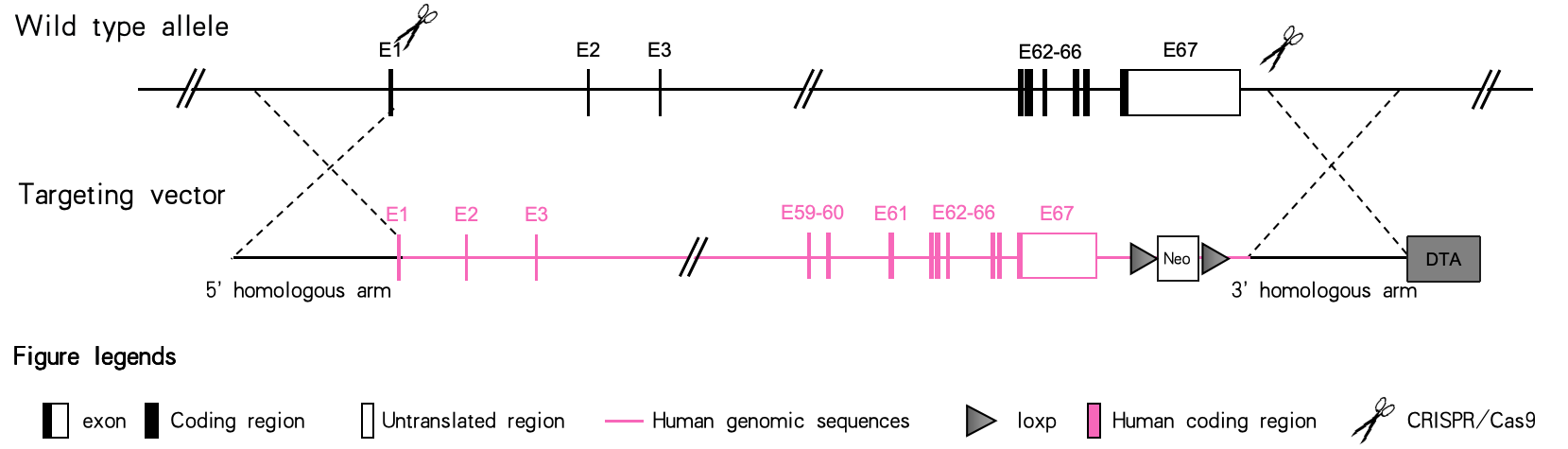
靶向策略示意图
该技术基于胚胎干细胞,模拟了ES细胞重组技术的流程和周期,其核心创新在于靶向载体免除体外线性化步骤。在同时电转靶向载体和sgRNA质粒进入干细胞后,通过阳性克隆筛选。整个项目大约需要12个月才能获得阳性杂合小鼠。
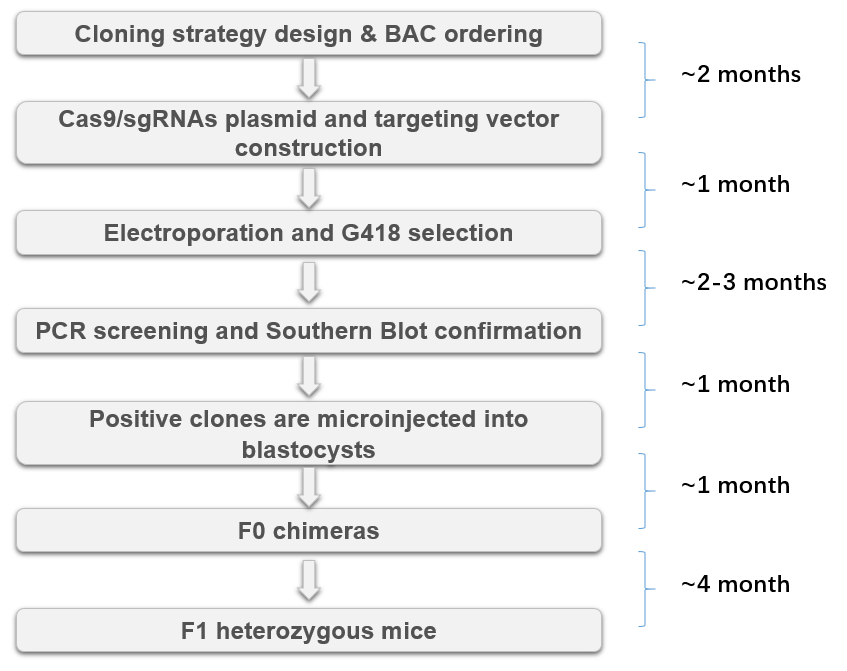
EGES技术工作流程