在此页面上
哮喘(Asthma)是一种由复杂的遗传、表观遗传和环境因素引起的慢性气道炎症性疾病。其典型症状为呼吸急促、喘息、咳嗽和过量的粘液分泌,常由过敏原诱发。这些临床表现源于气道高反应性(AHR)、可变的气流阻塞和免疫介导的炎症。在细胞水平上,气道上皮细胞、嗜酸性粒细胞和多种T细胞亚群在疾病进展中发挥关键作用。特别是Th2细胞在高嗜酸性粒细胞型哮喘中占主导地位,分泌IL-4、IL-5和IL-13等细胞因子,这些细胞因子驱动典型的疾病病理变化。
百奥赛图提供多种经过验证的哮喘小鼠模型,适用于治疗药物药效评估,包括卵清蛋白(Ovalbumin, OVA)、屋尘螨(House dust mite, HDM)、TSLP以及Alternaria诱导的模型。在OVA诱导模型中,小鼠通过腹腔注射OVA进行致敏,并通过雾化吸入OVA进行激发;HDM诱导模型则通过连续四周的鼻内反复给药建立。上述模型可稳定重现哮喘的典型特征,如IgE水平升高、嗜酸性粒细胞增多、气道黏液过度分泌以及白细胞浸润等。这些特征可通过ELISA检测和组织学分析进行验证。
| Readout | ||
| Included tests | Bronchoalveolar Lavage Fluid (BALF) | Cell numbers of Neutrophils, eosinophils, and macrophages |
| Serum | IgE level | |
| Histopathology | Bronchial mucus | |
| Immune infiltration | ||
| Histology scores | ||
| Optional tests | BALF | Total IgE, IL-4, IL-5, IL-13, TARC… |
| Lung tissue homogenate | IL-4, IL-5, IL-13, TARC… | |
| Lung tissue | IHC | |
| Airway function testing | Enhanced Pause (Penh) | |
哮喘小鼠支气管肺泡灌洗液(BALF)中的免疫细胞浸润
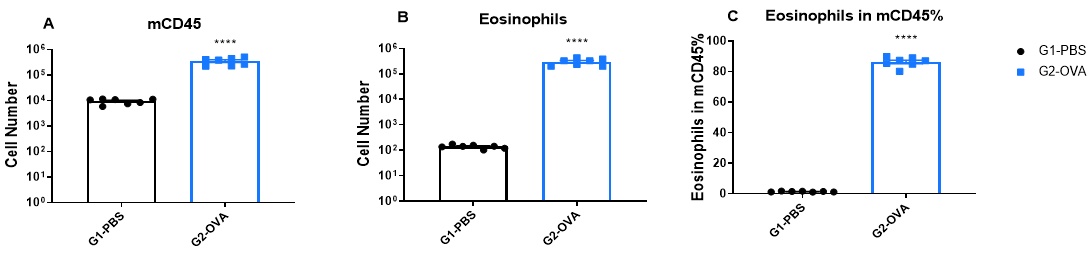
与对照组相比,OVA诱导的小鼠BALF中的免疫细胞数量增加。 实验结束时采集BALF,通过流式细胞术测定CD45+细胞数量(A)、嗜酸性粒细胞数量(B)及嗜酸性粒细胞在CD45+细胞中的百分比(C)。
哮喘小鼠血清中的IgE水平检测
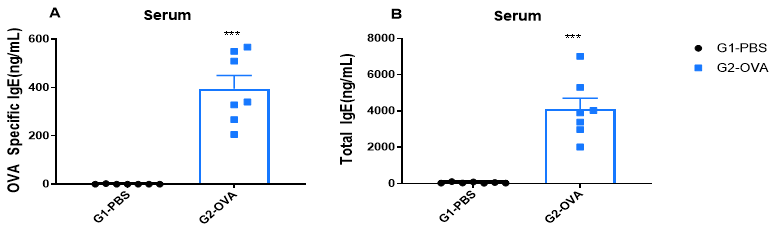
与对照组相比,OVA诱导的小鼠血清中的IgE水平增加。 实验结束时分离血清,通过ELISA测定OVA特异性IgE(A)和血清总IgE(B)的浓度。
哮喘小鼠模型的气道组织病理分析
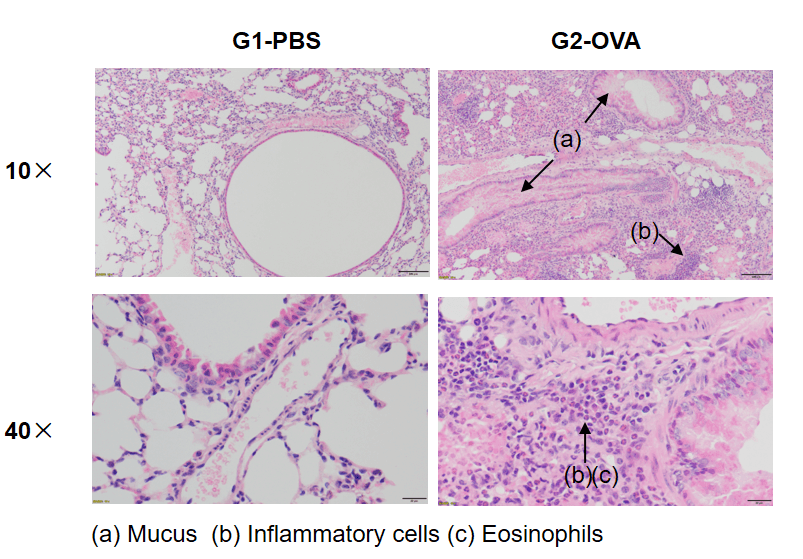
OVA成功诱导野生型C57BL/6小鼠产生哮喘相关病理特征。 肺组织的H&E染色显示,OVA处理组(G2)小鼠的哮喘相关病理变化,包括血管周围和支气管周围的炎症细胞浸润(b),以及部分支气管内的黏液积聚(a),而对照组(G1)则未见上述病理特征。
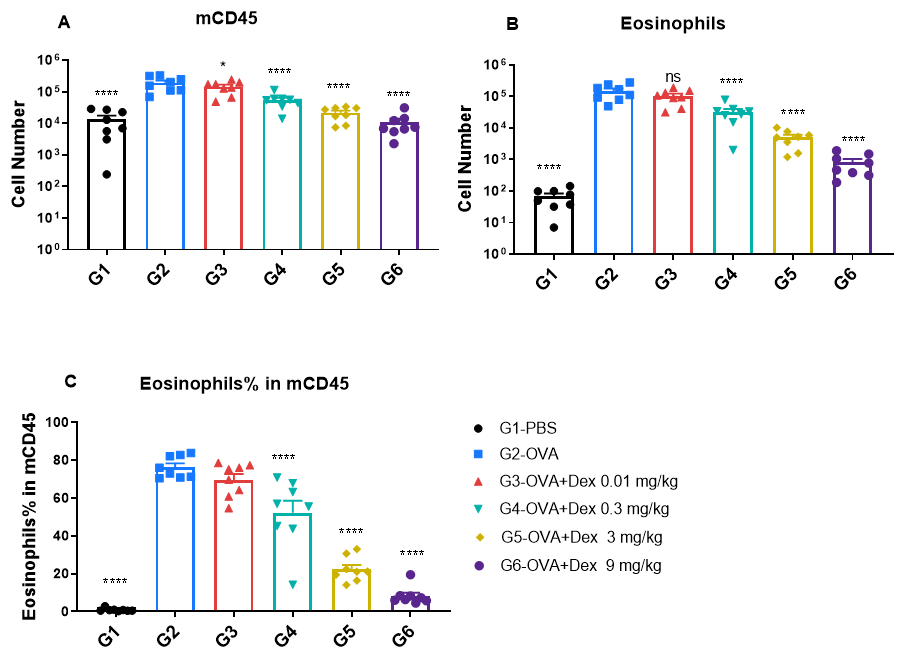
OVA诱导的哮喘BALB/c小鼠BALF中免疫细胞的定量分析。 通过OVA致敏和激发在野生型BALB/c小鼠中诱导哮喘模型。(A)BALF中CD45⁺总白细胞计数;(B)BALF中嗜酸性粒细胞计数;(C)CD45⁺细胞中嗜酸性粒细胞的比例。与PBS处理的对照组(G1)相比,OVA诱导的哮喘组(G2)小鼠BALF中的总白细胞和嗜酸性粒细胞数量显著升高,验证了模型构建的成功。相比未经治疗的G2组,地塞米松处理可显著降低CD45⁺细胞和嗜酸性粒细胞的水平。
哮喘小鼠模型的气道组织病理分析
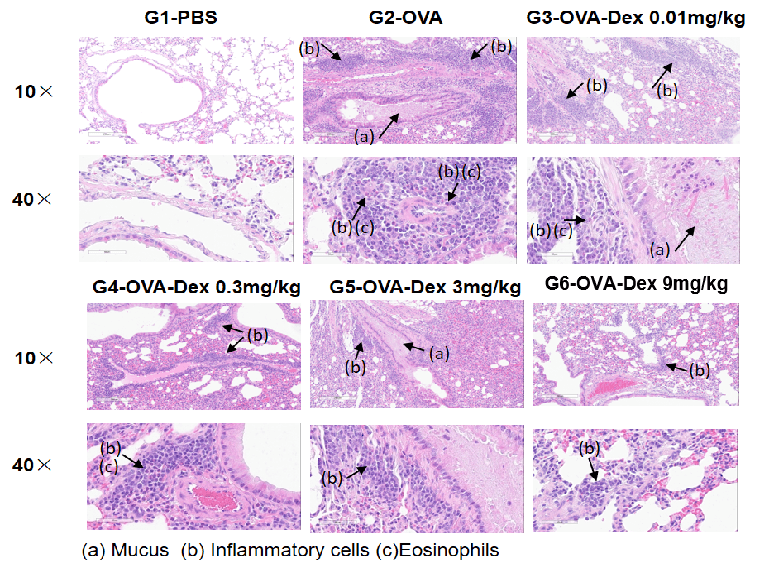
OVA诱导的哮喘小鼠肺组织H&E染色。
组织学分析显示,G1对照组肺部无明显炎症。G2组(仅OVA处理)表现出显著的血管周围及支气管周围炎症反应和黏液分泌增加,表明哮喘模型成功构建。地塞米松治疗组(G3)则显示炎性细胞浸润和黏液生成明显减少。上述结果验证了OVA诱导的BALB/c小鼠模型可作为糖皮质激素类免疫抑制药物药效评价的平台。
哮喘小鼠血清中IgE诱导水平

基于ELISA的OVA诱导哮喘小鼠血清IgE检测。
通过ELISA检测OVA特异性IgE(A)和总IgE(B)的血清水平。G2组(仅OVA处理)的IgE水平显著高于G1对照组,表明哮喘模型成功构建。地塞米松治疗组(G3)以剂量依赖的方式降低了OVA特异性IgE和总IgE水平,支持其免疫抑制药效。
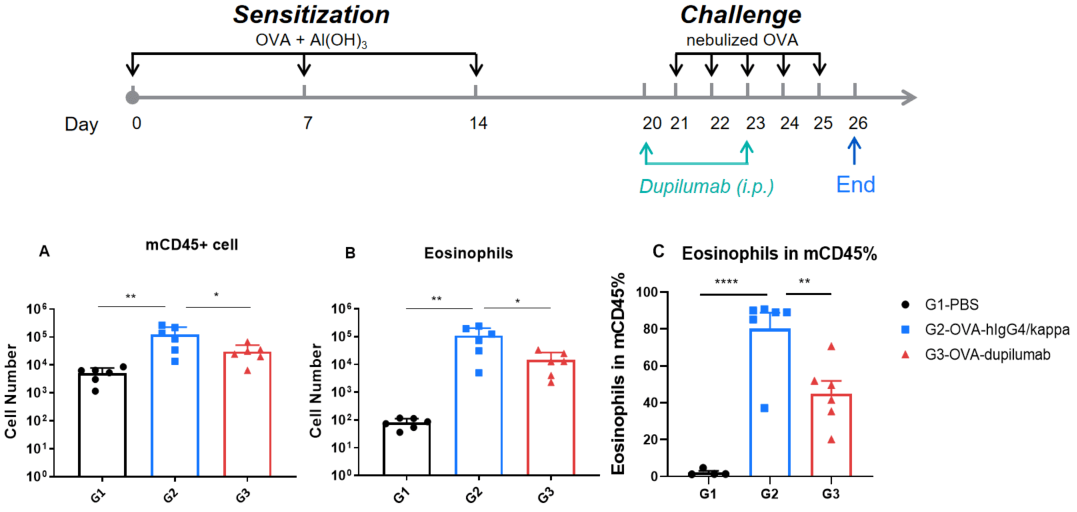
OVA诱导的B-hIL4/hIL4RA哮喘小鼠BALF中免疫细胞的定量分析。
在B-hIL4/hIL4RA人源化小鼠中,通过OVA致敏和激发建立哮喘模型。(A)CD45⁺细胞总数,(B)嗜酸性粒细胞数量,(C)嗜酸性粒细胞在CD45⁺细胞中的比例。结果显示,G2组(仅OVA处理)小鼠的BALF中白细胞浸润和嗜酸性粒细胞水平显著高于G1对照组,表明模型构建成功。应用dupilumab(内部制备)处理后,CD45⁺细胞和嗜酸性粒细胞数量相较于G2组显著下降,验证了该药物在该模型中的药效。
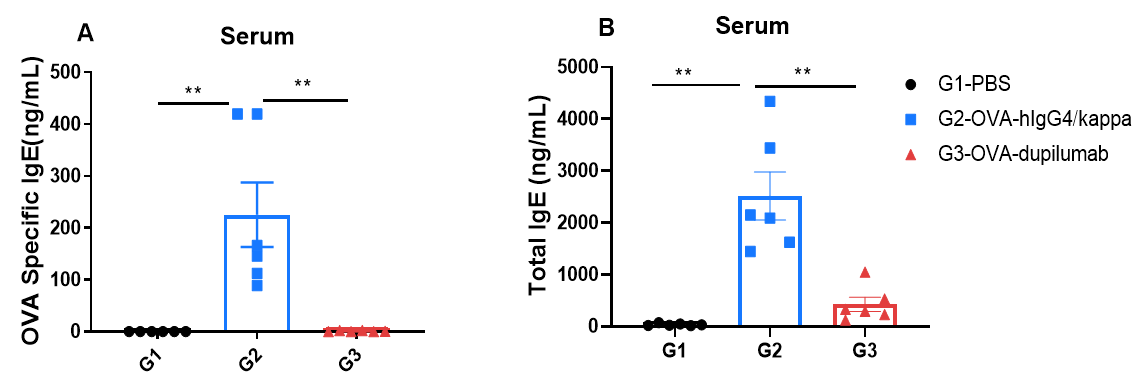
基于ELISA方法检测OVA诱导哮喘小鼠模型血清IgE水平。
通过ELISA方法定量检测血清中OVA特异性IgE(A)和总IgE(B)水平。结果显示,G2组(仅OVA处理)小鼠的IgE水平相较于G1对照组显著升高,验证了哮喘模型的成功建立。经dupilumab(内部制备)治疗后,OVA特异性IgE和总IgE水平相较于G2组显著下降,表明该药物在本模型中具有良好的免疫抑制效果。
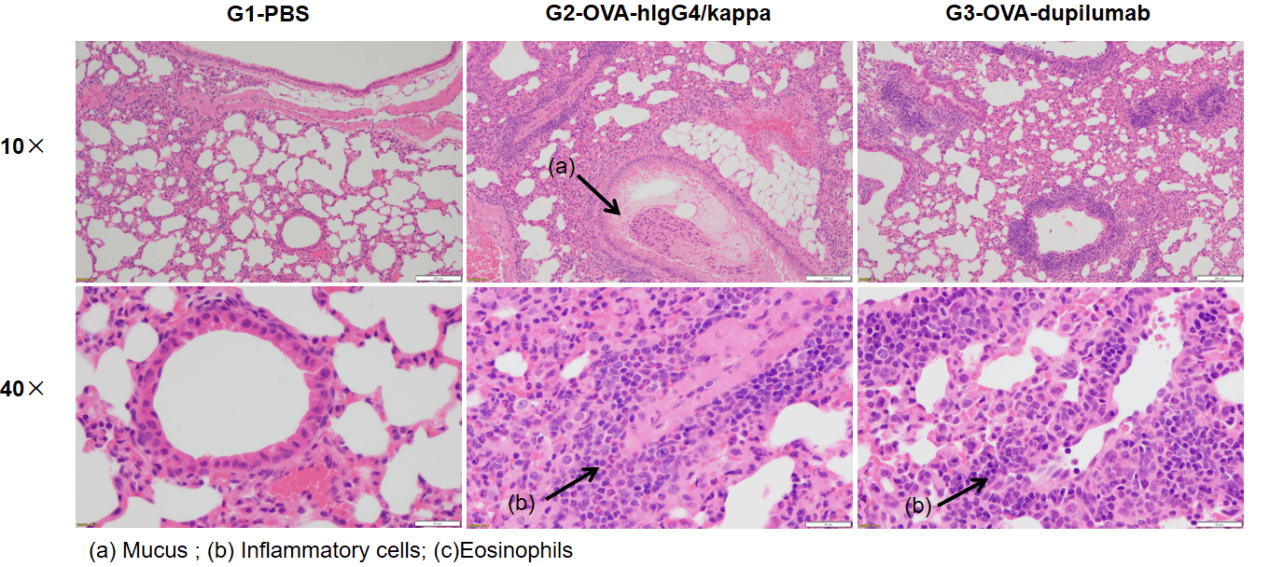
OVA诱导的B-hIL4/hIL4RA哮喘小鼠模型肺组织H&E染色。 组织病理分析显示G1对照组未见气道炎症。G2组(仅OVA处理)小鼠表现出显著的血管及支气管周围炎症(b)和黏液分泌增加(a),验证了哮喘模型构建成功。G3组经dupilumab(内部制备)治疗后,炎症细胞浸润及黏液分泌明显减少。上述结果表明,OVA诱导的B-hIL4/hIL4RA人源化小鼠模型可用于抗哮喘候选药物的体内药效评价。

DSI Buxco FinePointe WBP:非侵入式呼吸监测系统
FinePointe全身肺容积描记法(WBP)系统可实现对清醒、自由活动动物的精确呼吸评估:

每次测试需40-60分钟,适用于2-4只小鼠的气道功能测试。
B-hIL4/hIL4RA mice (C57BL/6)
B-hIL4/hIL4RA mice (BaIb/c)
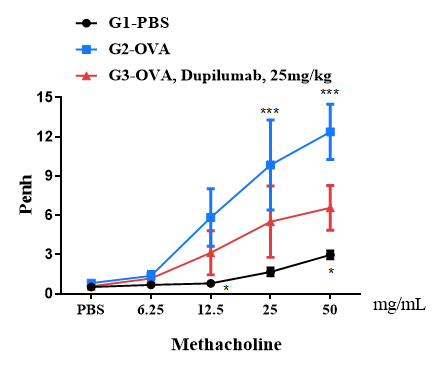
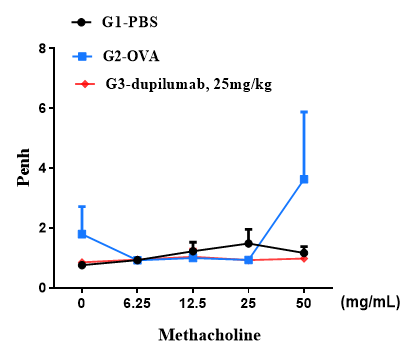
在最终过敏原或PBS暴露24小时后,使用全身体积描记法测量小鼠在暴露于不同剂量的甲基胆碱(Methacholine, MCh)后的气道反应。y轴表示Penh绝对值。通过气雾剂递增给药MCh。
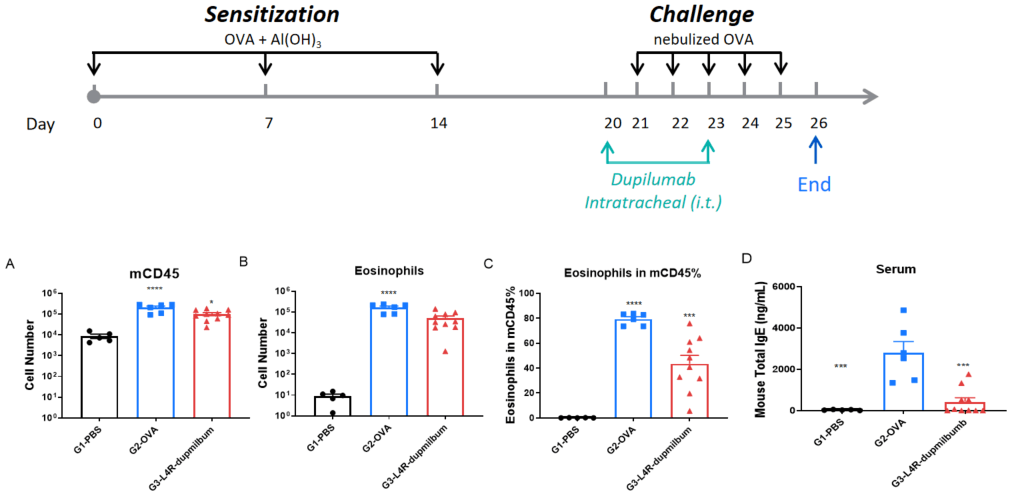
B-hIL4/hIL4RA小鼠通过气管内(i.t.)给药进行OVA致敏和激发诱导哮喘模型。通过气管内给予Dupilumab治疗。图表显示了总白细胞数(A),嗜酸性粒细胞数(B),CD45⁺细胞中的嗜酸性粒细胞百分比(C)和血清总IgE水平(D)。结果表明,Dupilumab显著降低了气道炎症水平和IgE含量。
| Readout | ||
| Included tests | Bronchoalveolar Lavage Fluid (BALF) | Cell numbers of Neutrophils, eosinophils, and macrophages |
| Serum | IgE level | |
| Histopathology | Bronchial mucus | |
| Immune infiltration | ||
| Histology scores | ||
| Optional tests | BALF | Total IgE, IL-4, IL-5, IL-13, TARC… |
| Lung tissue homogenate | IL-4, IL-5, IL-13, TARC… | |
| Lung tissue | IHC | |
| Airway function testing | Enhanced Pause (Penh) | |
哮喘小鼠BALF中免疫细胞浸润
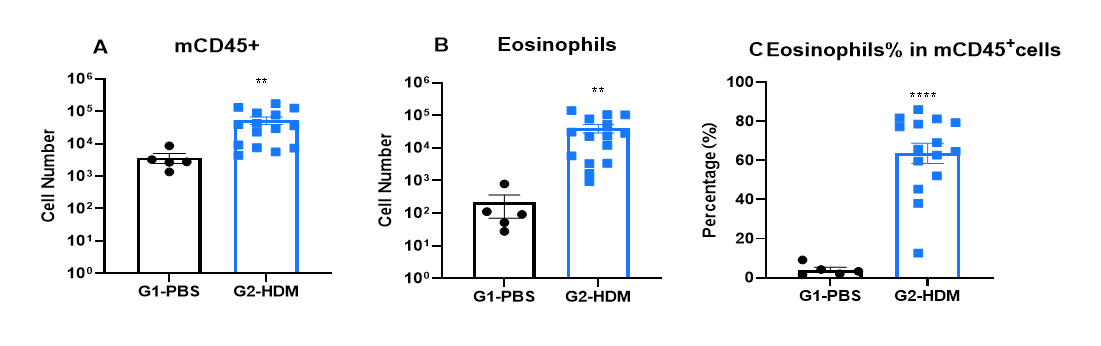
OVA诱导的IL4和IL4受体人源化(B-hIL4/hIL4RA)哮喘小鼠的BALF免疫细胞分析。
通过OVA致敏和激发在B-hIL4/hIL4RA小鼠中建立哮喘模型。(A)BALF中CD45⁺白细胞计数,(B)嗜酸性粒细胞计数,(C)CD45⁺细胞中嗜酸性粒细胞的比例用于评估炎症水平。G2组(仅OVA处理)小鼠相比G1对照组表现出显著的白细胞浸润和嗜酸性粒细胞增多,表明模型构建成功。
哮喘小鼠血清中的IgE诱导水平
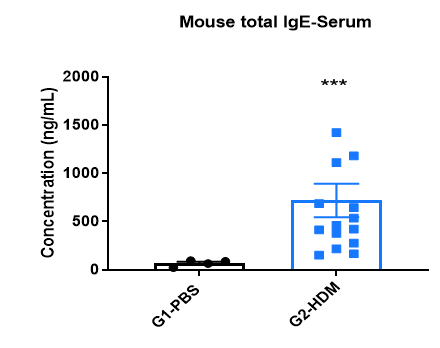
与对照组相比,HDM诱导的小鼠血清中IgE水平升高。 实验结束时取血清,使用ELISA测定总IgE浓度。
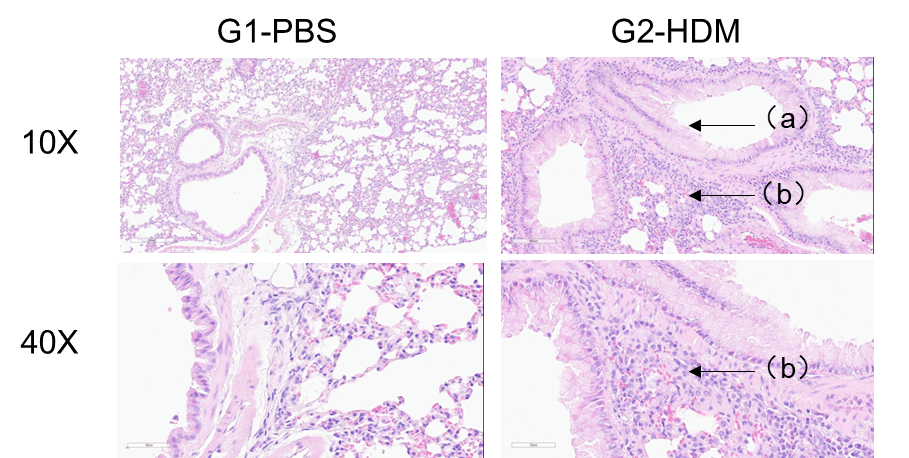
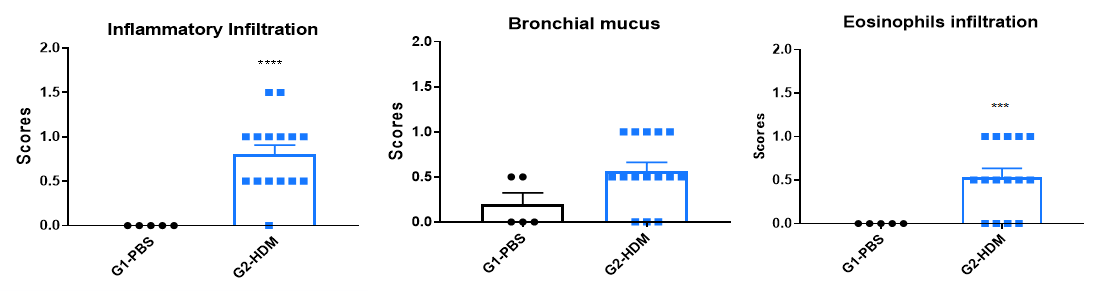
HDM诱导的C57BL/6哮喘小鼠肺组织H&E染色。 与G1对照组相比,G2小鼠接受屋尘螨(HDM)处理后,表现出典型的哮喘病理特征,包括血管和支气管周围的炎症细胞浸润(b)和黏液分泌(a)。这些结果表明HDM能够成功地诱导野生型C57BL/6小鼠哮喘模型构建。
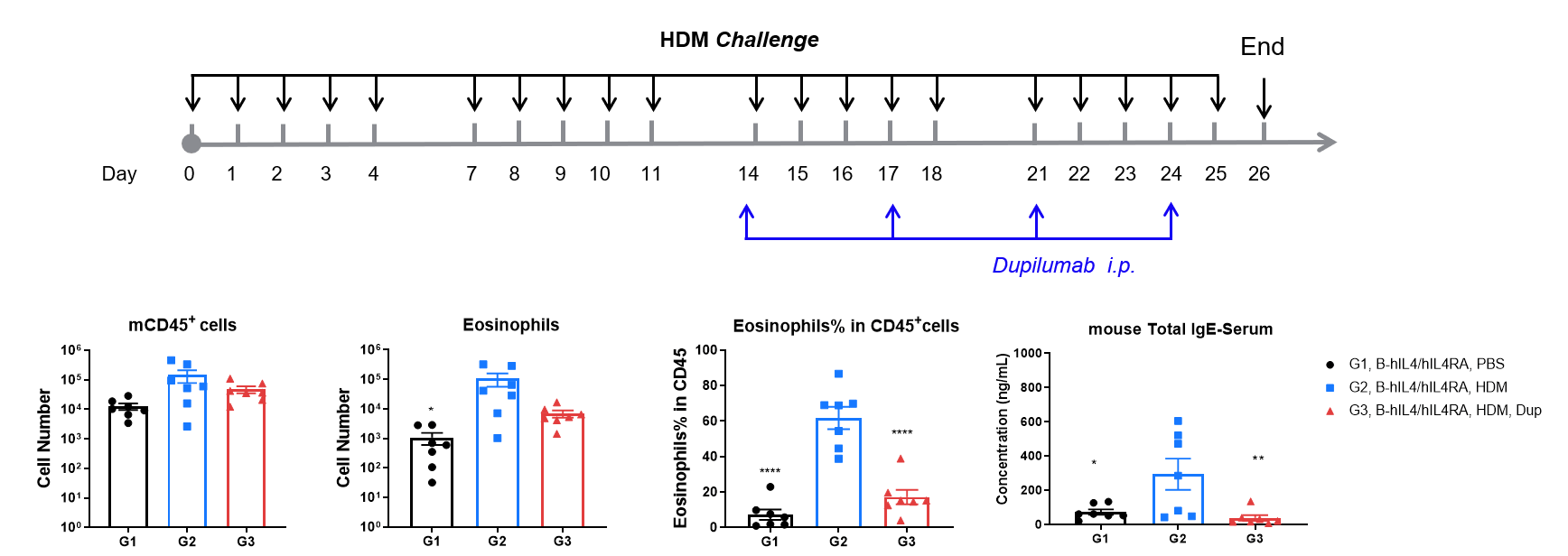
抗人IL-4R抗体(Dupilumab)在IL-4和IL-4受体人源化(B-hIL4/hIL4RA)小鼠HDM诱导的哮喘模型中的药效评估。
在HDM致敏和激发后,G2组小鼠支气管肺泡灌洗液(BALF)中CD45⁺白细胞总数、嗜酸性粒细胞数量及其在CD45⁺细胞中的比例均显著高于G1对照组,表明哮喘模型建立成功。给予公司自研Dupilumab(25 mg/kg)治疗后,CD45⁺细胞和嗜酸性粒细胞数量显著下降。终点时通过ELISA检测的血清总IgE水平在G2组显著升高,Dupilumab处理后明显降低,进一步验证了IL-4R阻断的治疗效果。
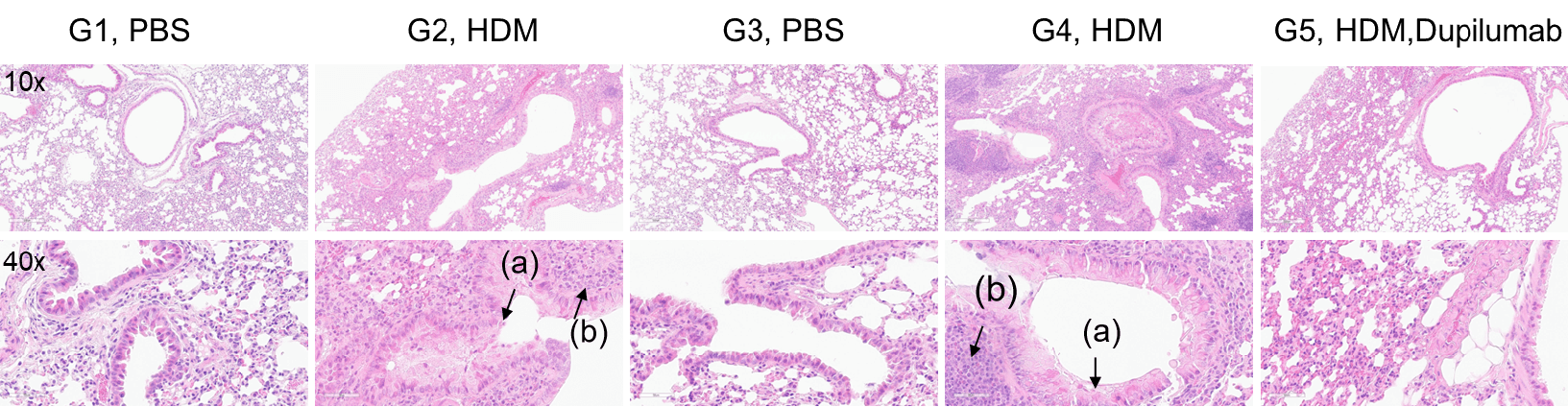
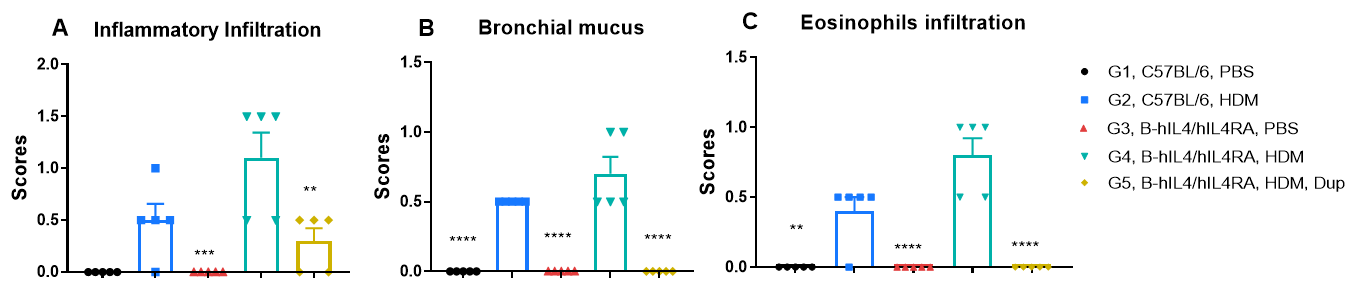
HDM诱导的哮喘小鼠肺组织H&E染色。 与G1(C57BL/6)和G3(B-hIL4/hIL4RA)未处理的对照组相比,G2(C57BL/6)和G4(B-hIL4/hIL4RA)小鼠接受HDM处理后,表现出典型的哮喘病理特征,包括支气管周围和血管周围的混合炎症细胞浸润(b)和支气管中黏液积聚(a)。Dupilumab治疗显著减少了上述病理特征,表明在HDM诱导的过敏性哮喘模型中,阻断IL-4R具有良好的治疗效果。
| Readout | ||
| Included tests | Bronchoalveolar Lavage Fluid (BALF) | Cell numbers of Neutrophils, eosinophils, and macrophages |
| Serum | IgE level | |
| Histopathology | Bronchial mucus | |
| Immune cell infiltration | ||
| Histology scores | ||
| Optional tests | BALF | Total IgE, IL-4, IL-5, IL-13, TARC… |
| Lung tissue homogenate | IL-4, IL-5, IL-13, TARC… | |
| Lung tissue | IHC | |
| Airway function testing | Enhanced Pause (Penh) | |
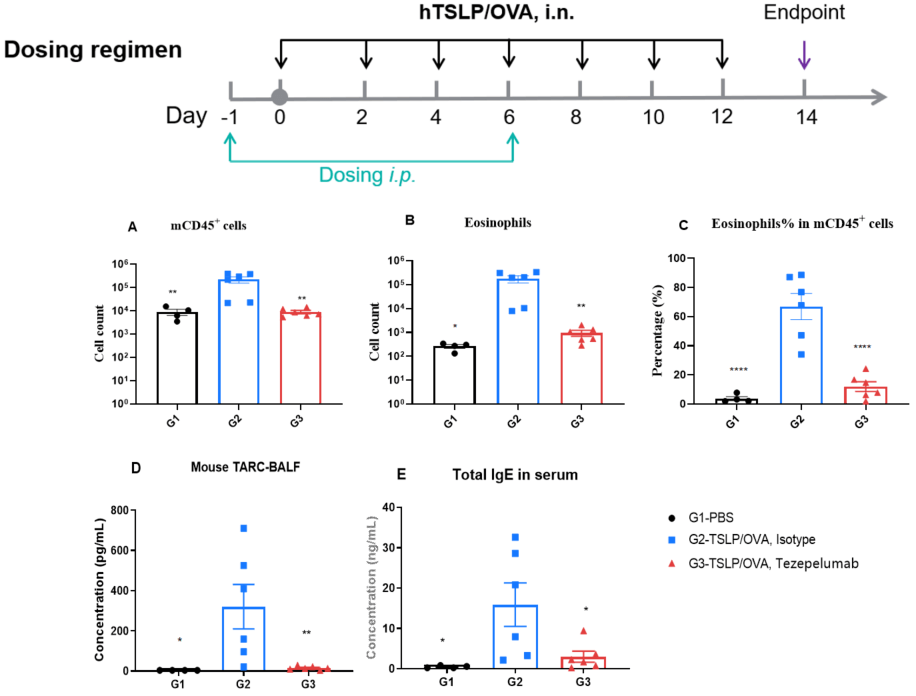
抗人TSLP抗体(Tezepelumab)在TSLP和TSLP受体人源化(B-hTSLP/hTSLPR)小鼠中TSLP/OVA诱导的哮喘模型的药效评估。 OVA/TSLP致敏诱导B-hTSLP/hTSLPR小鼠哮喘模型,G2组相比于G1对照组表现出支气管肺泡灌洗液(BALF)中CD45⁺白细胞总数、嗜酸性粒细胞数量及其比例显著升高。经给予Tezepelumab(内部制备)治疗后,CD45⁺细胞与嗜酸性粒细胞显著下降。终点时ELISA检测结果显示,G2组BALF中的TARC水平和血清总IgE浓度亦明显升高,Tezepelumab处理后这些指标均显著下降,验证了TSLP阻断在该过敏性哮喘模型中的治疗效果。
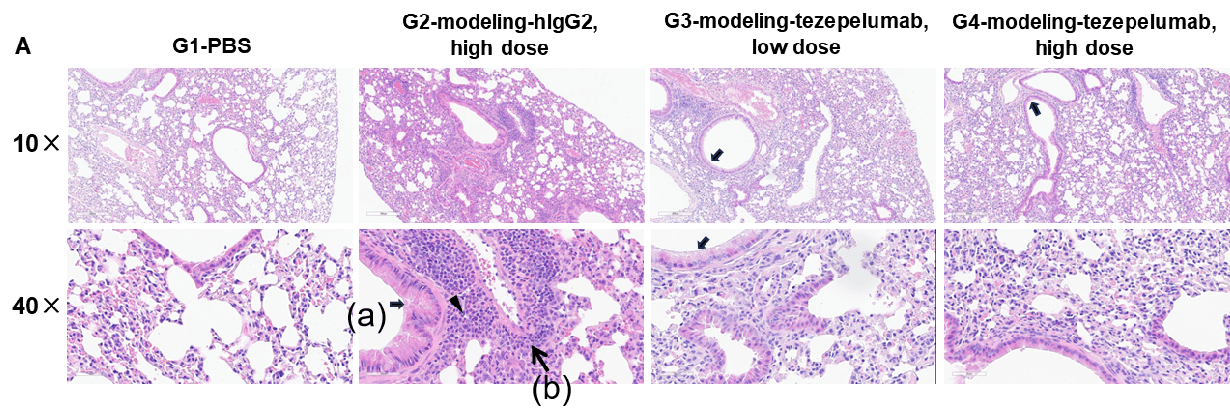
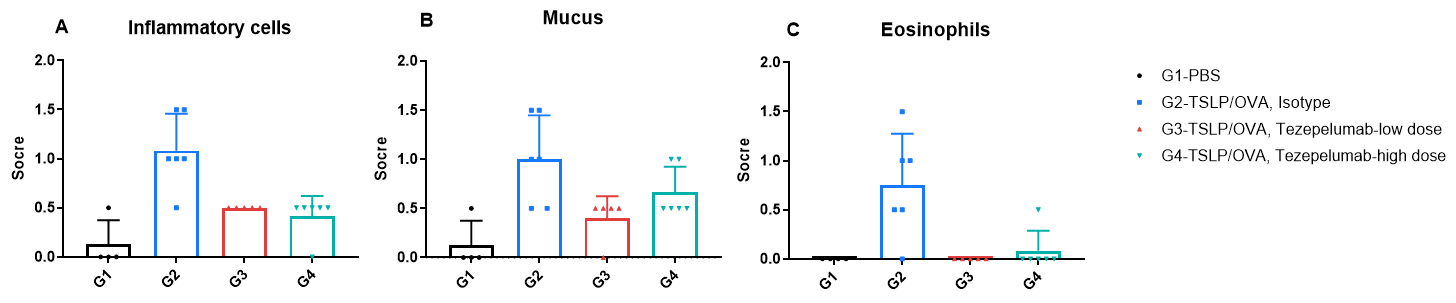
TSLP/OVA诱导的哮喘模型中B-hTSLP/hTSLPR小鼠肺组织H&E染色和组织病理评分。
与G1组(PBS处理对照组)相比,G2组(TSLP/OVA + 同型对照)小鼠表现出典型的哮喘病理特征,包括血管和支气管周围混合型炎性细胞浸润(b)以及支气管内黏液堆积(a)。G3组(低剂量)和G4组(高剂量)Tezepelumab治疗后,气道炎症和黏液分泌均呈剂量依赖性下降。G2组小鼠中观察到的炎性细胞浸润、黏液产生及嗜酸性粒细胞增加现象,在抗TSLP治疗后均有所缓解,进一步验证了Tezepelumab在该过敏性哮喘模型中的治疗潜力。