在此页面上
安全性问题是临床试验中药物失败的3个主要原因之一。为了解决这一问题,早期阶段的non-GLP毒理学研究至关重要,它提供了宝贵的转化信息,使药物研发企业能够更好地评估药物开发过程中的风险和收益。百奥赛图病理学平台提供先进的病理诊断与分析、毒理学研究、生物标志物分析以及不同物种和疾病模型的组织病理学分析,旨在支持药物发现工作。我们的平台配备了血常规和血生化全自动分析设备,高通量组织切片及组织芯片制备,包括H&E、IHC、IF及多色免疫荧光在内的全面染色技术,以及HALO AI数据分析系统,以促进药效评估、毒理学机制研究及临床转化研究,为药物开发过程提供了全面的支持。
我们的病理学平台提供以下全面的服务:













9名病理学家、10名高级技术员和2名项目经理
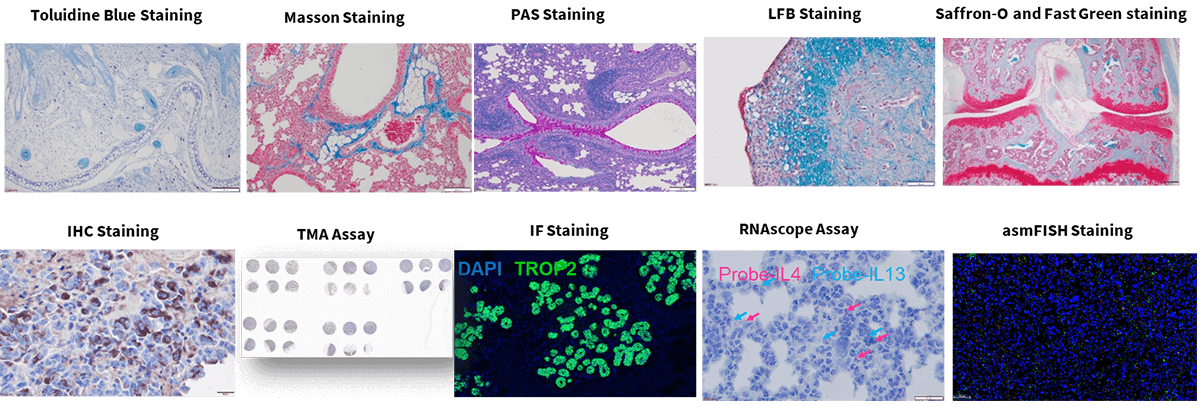
这是石蜡和冷冻切片中最常用的方法之一。它通过使用辅助方法来确保诊断的准确性和完整性,从而促进病理诊断。核、细胞质和软骨分别染成蓝黑色、粉红色和蓝色。
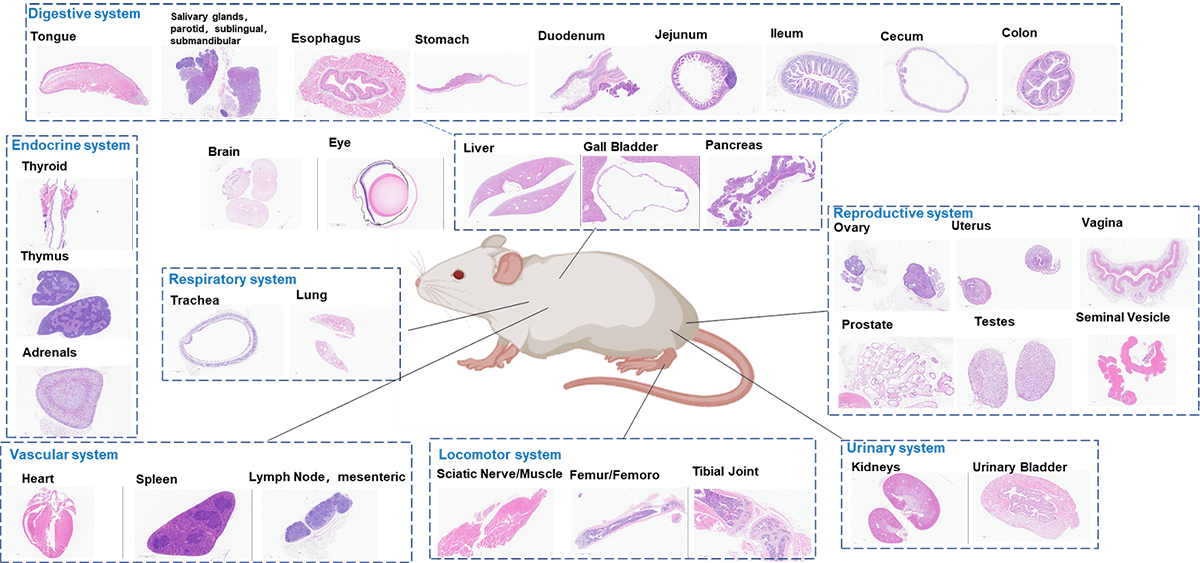
小鼠组织的代表性H&E染色
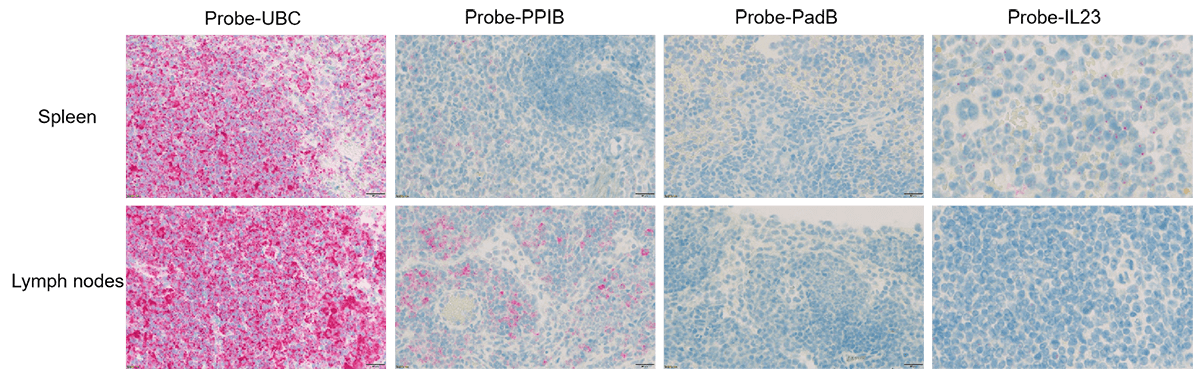
在银屑病组织中进行RNAscope单染色检测分析
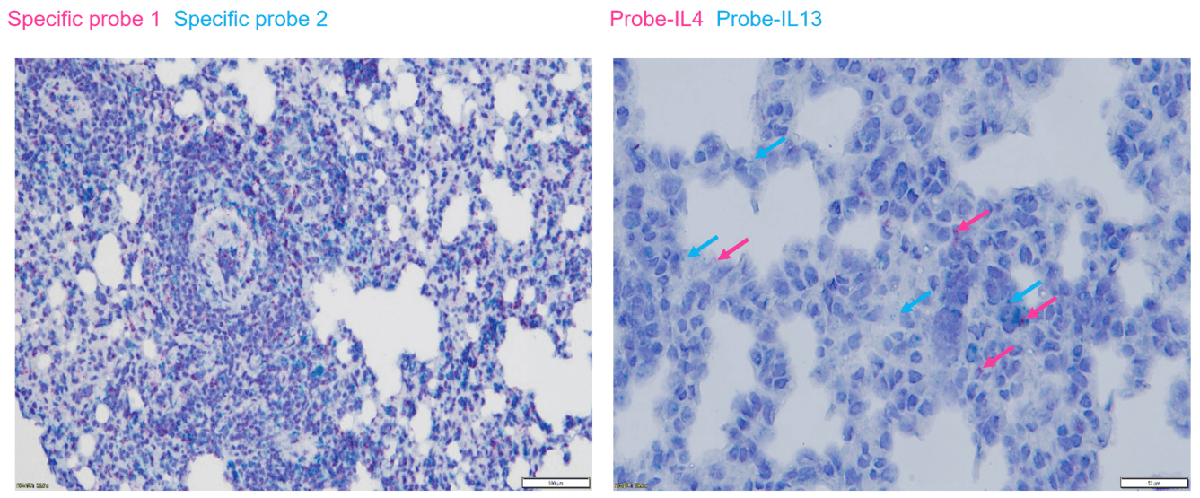
在哮喘肺组织中进行RNAscope双染色检测分析
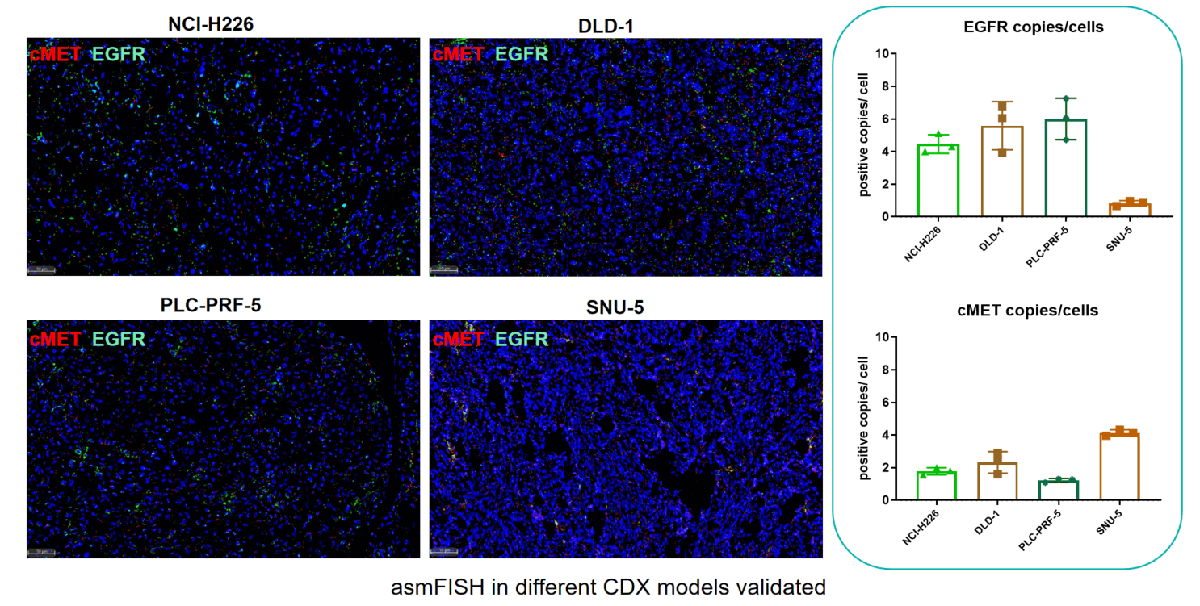
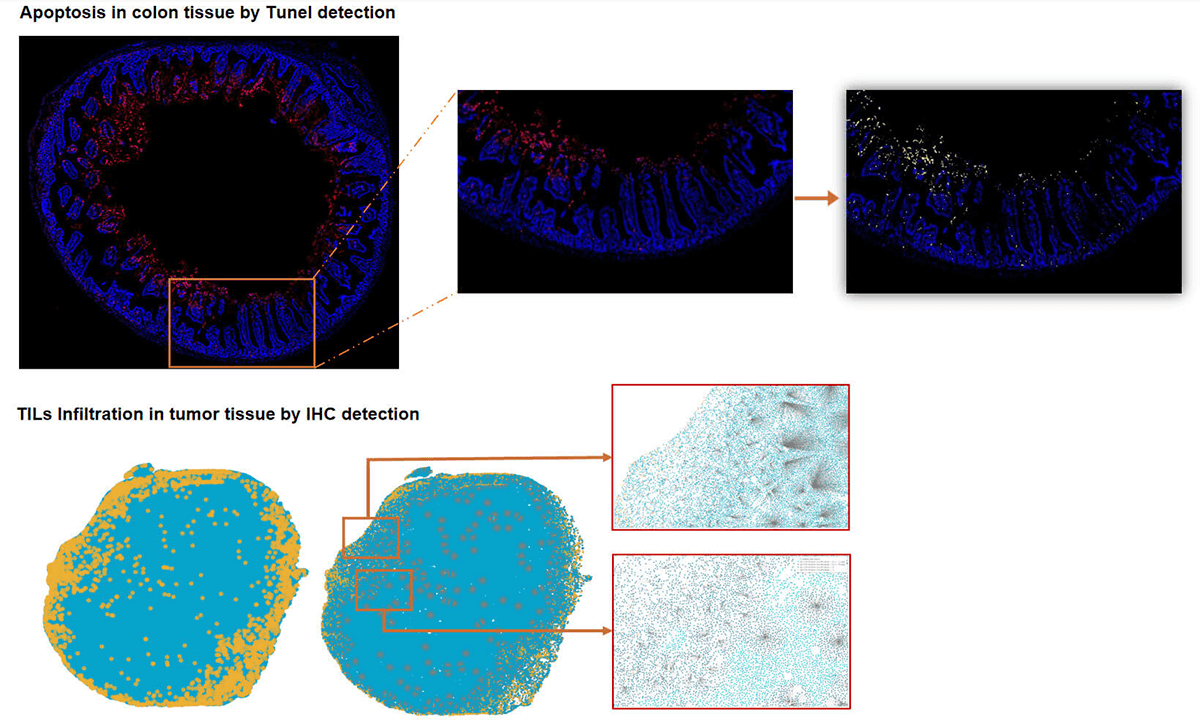
IHC/Tunel染色和分析-HALO分析
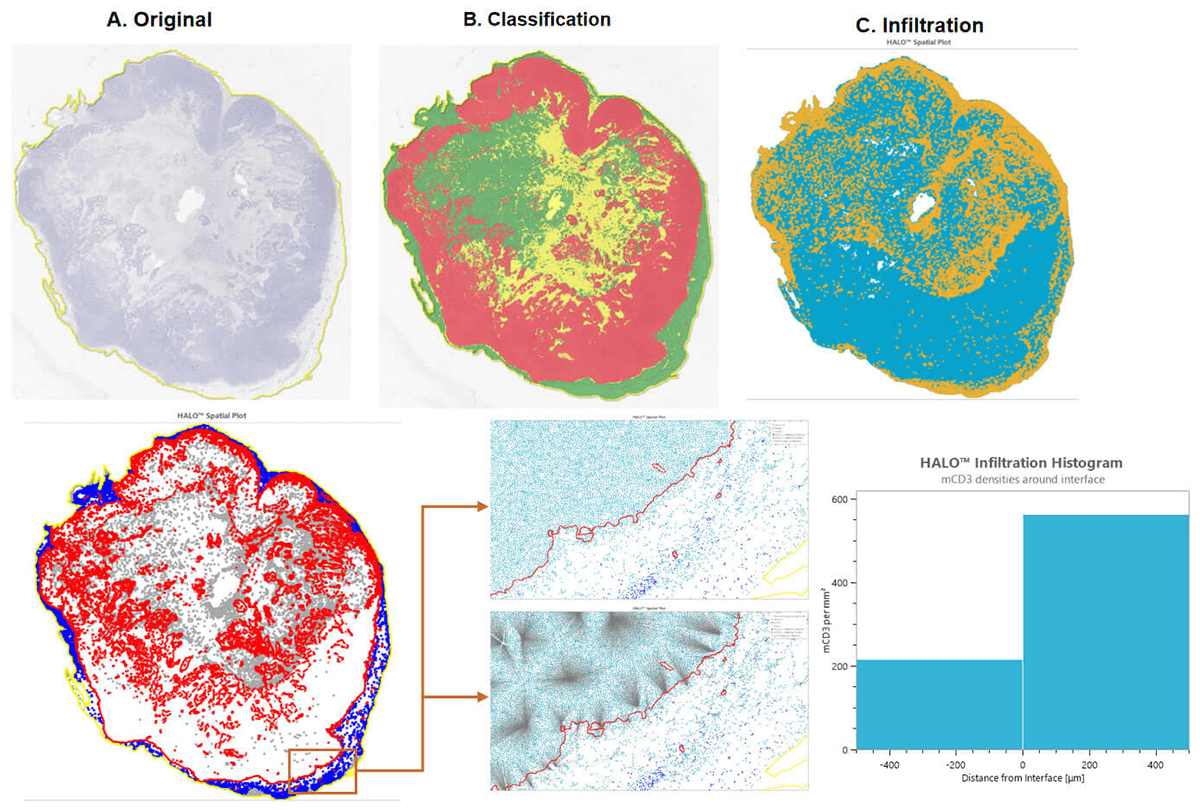
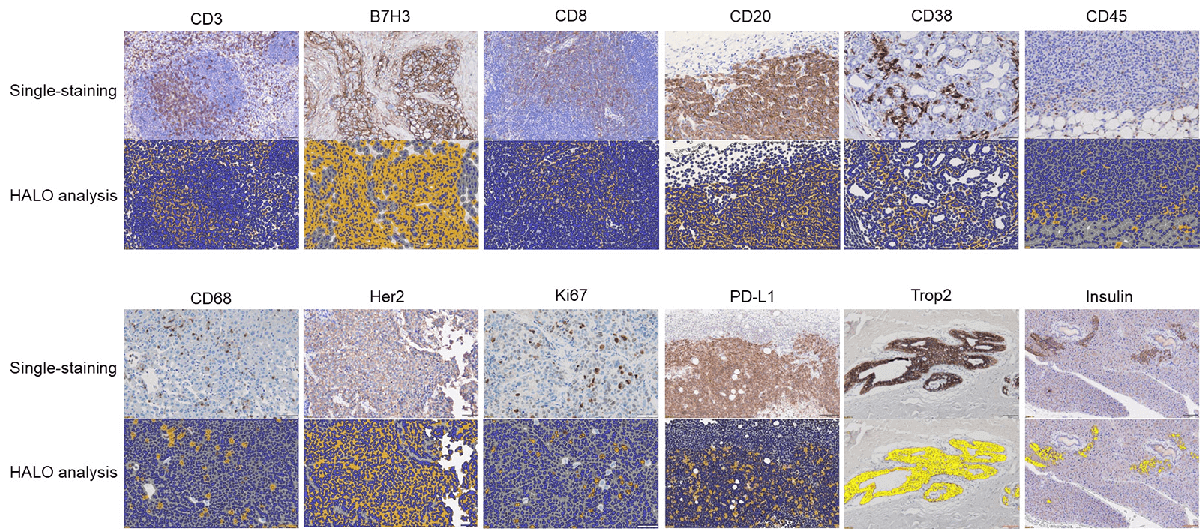
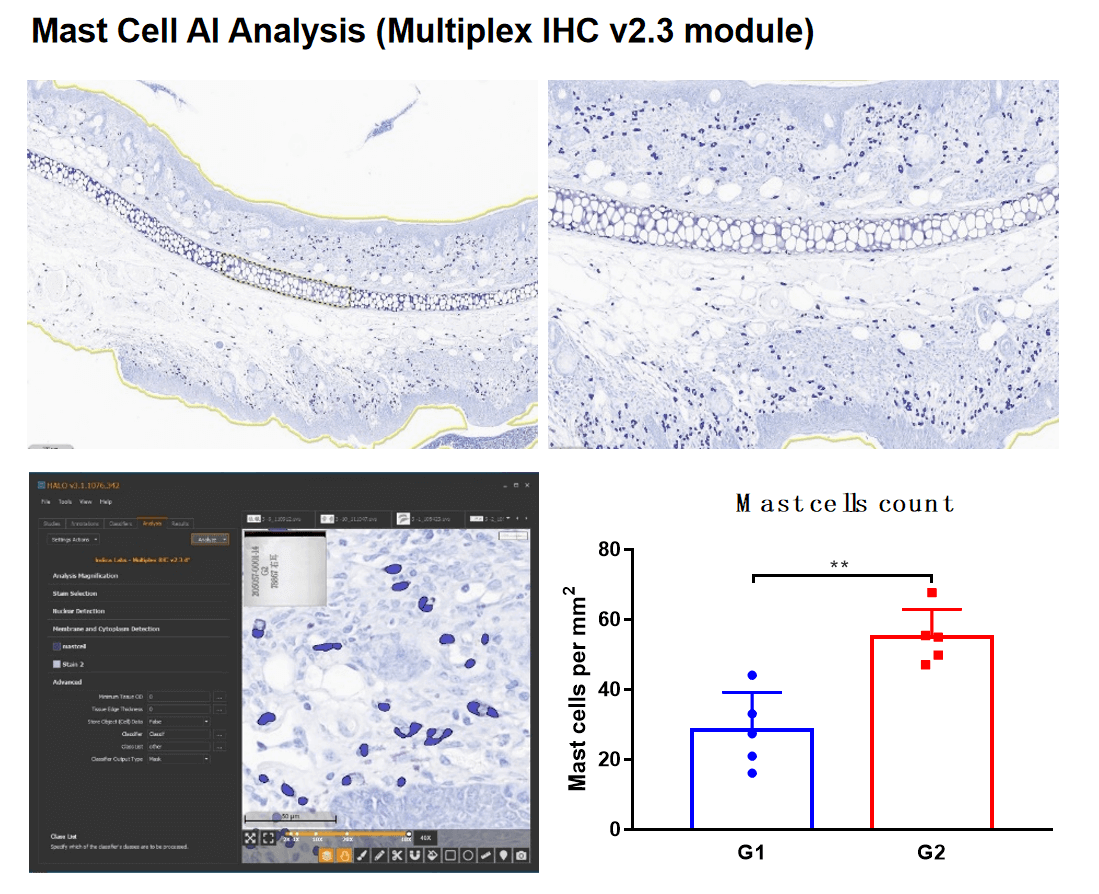
IHC染色和分析-HALO分析
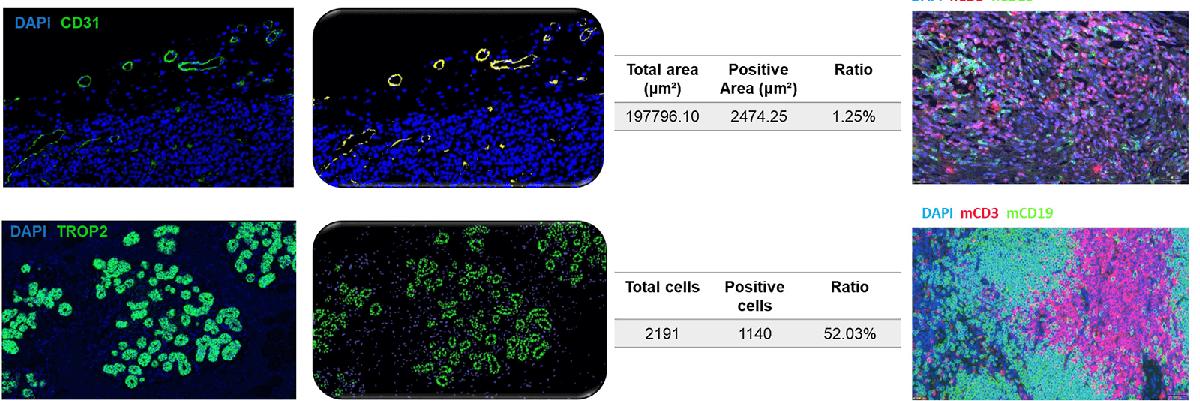
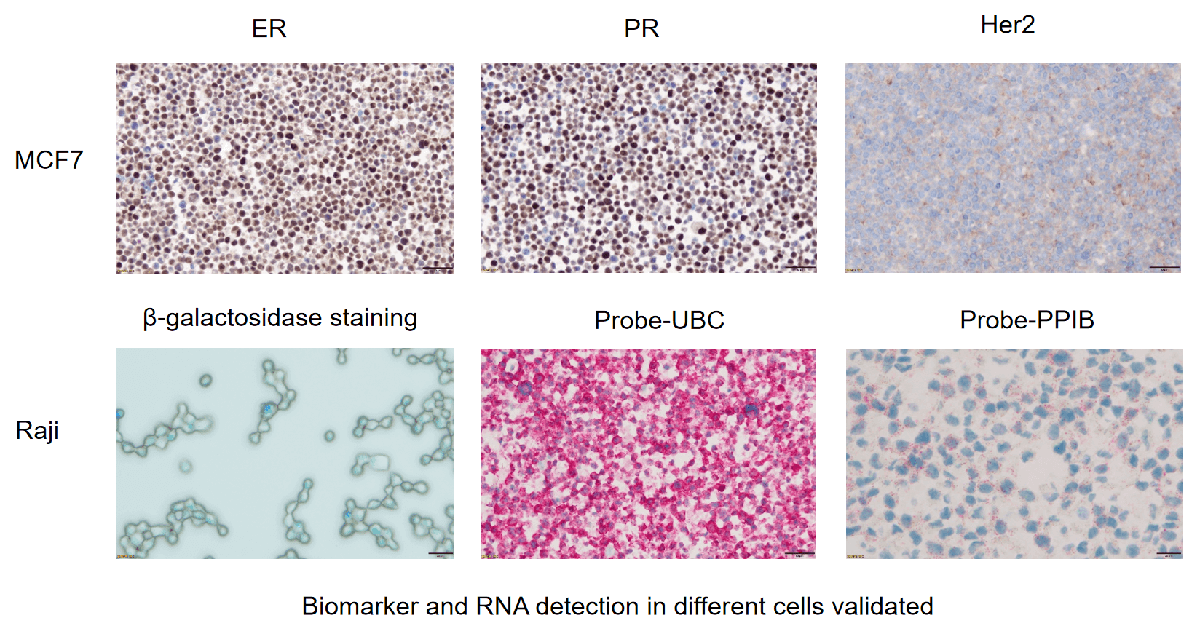
IF/TSA检测-HALO分析
IHC检测-HALO分析
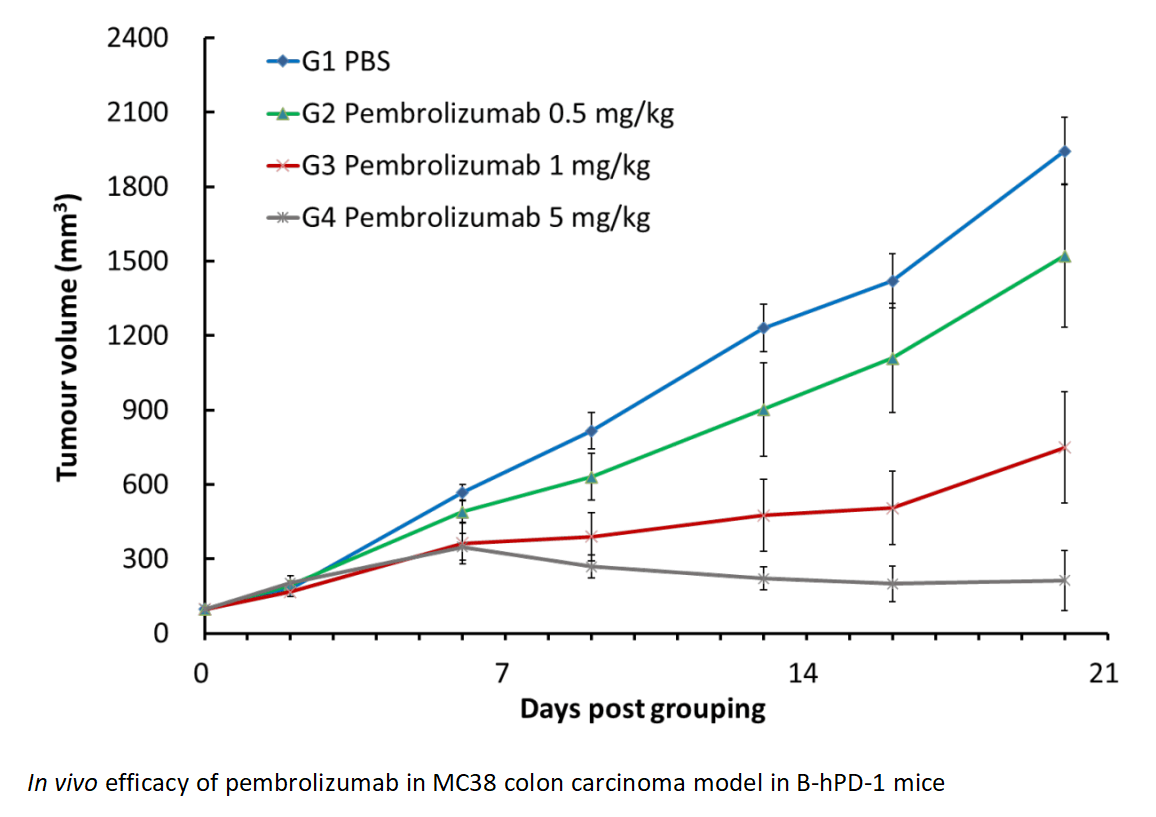
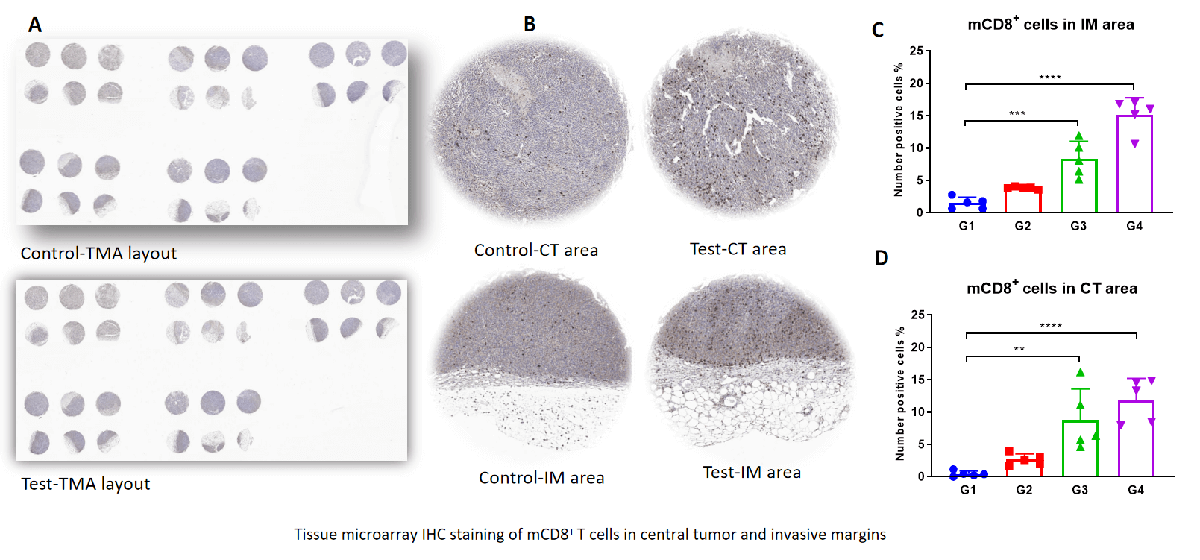
帕博利珠单抗(Pembrolizumab)在B-hPD-1小鼠的MC38同种异体模型中展示了显著的剂量依赖性抗肿瘤效果。与对照组相比,G4组巨噬细胞中的PD-1表达减少,表明巨噬细胞是抗PD-1治疗中的关键效应细胞。
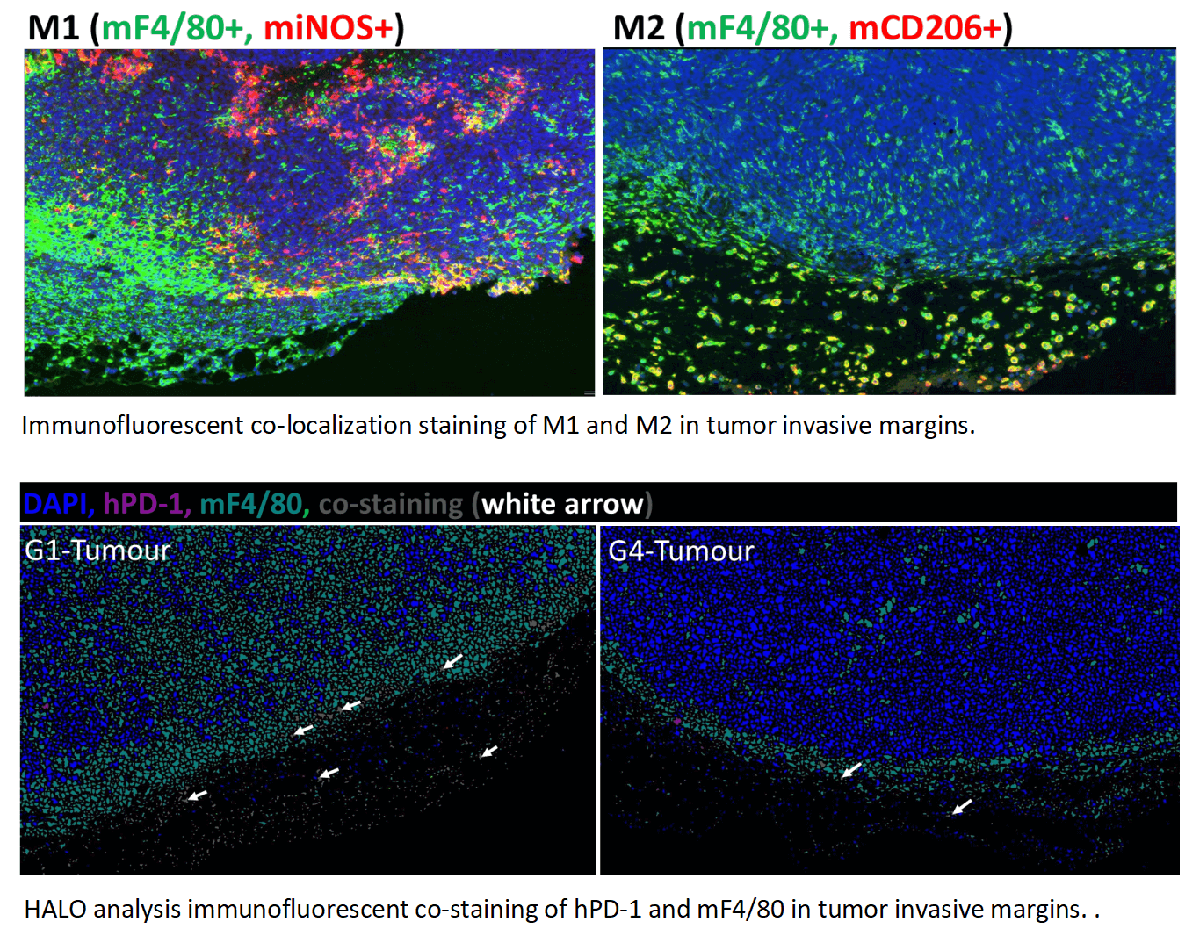
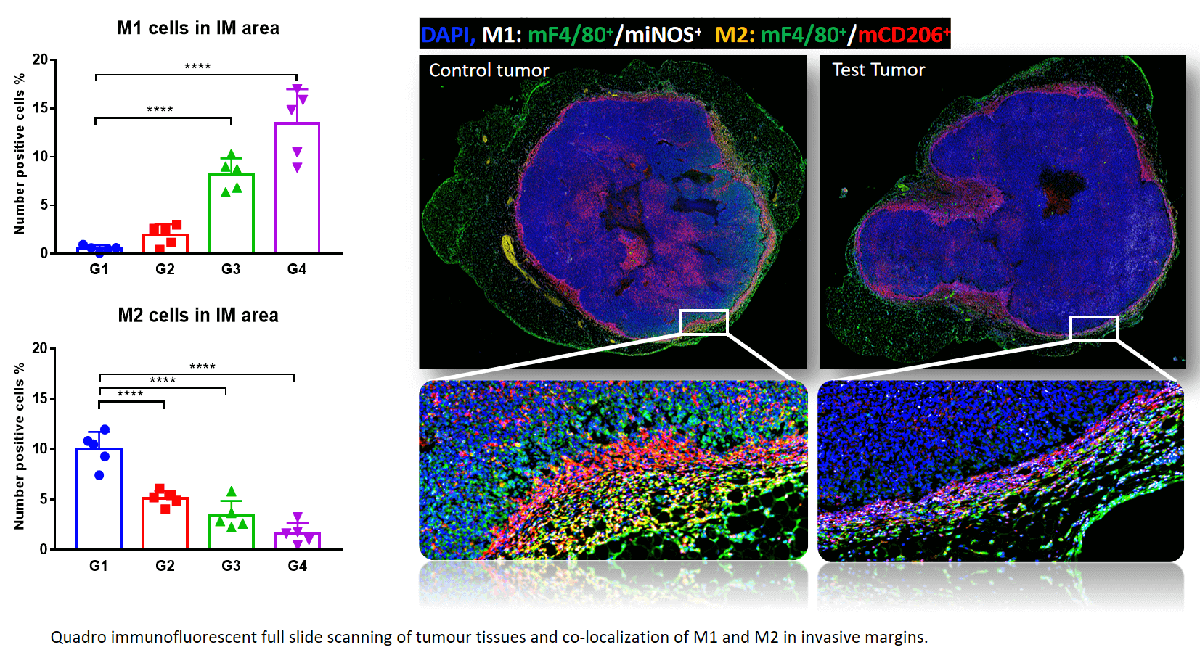
在MC38肿瘤的侵袭性边缘发现M1显著增加,而M2在Pembrolizumab治疗下显著下降,且具有剂量依赖性。这表明M1的浸润促进了抗PD-1介导的肿瘤生长抑制。
TMA染色显示,CD8+ T (CTL)细胞在Test的肿瘤侵袭性边缘和中央肿瘤区域显著增加。这与M1/M2比率的增加相关。
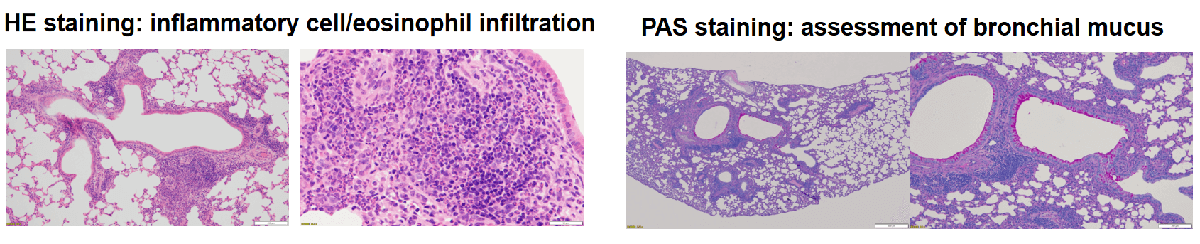
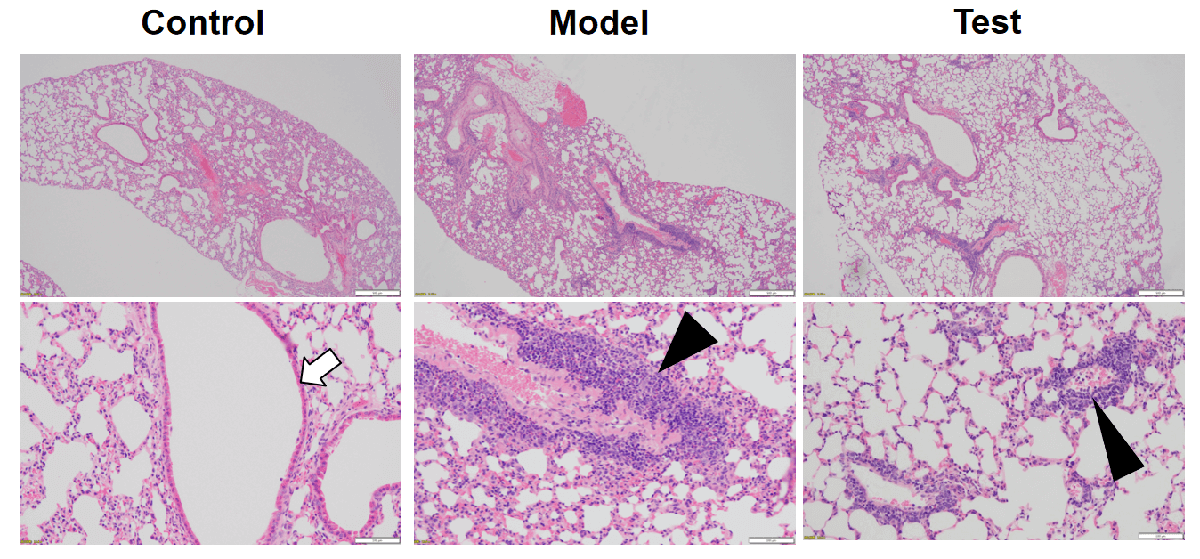
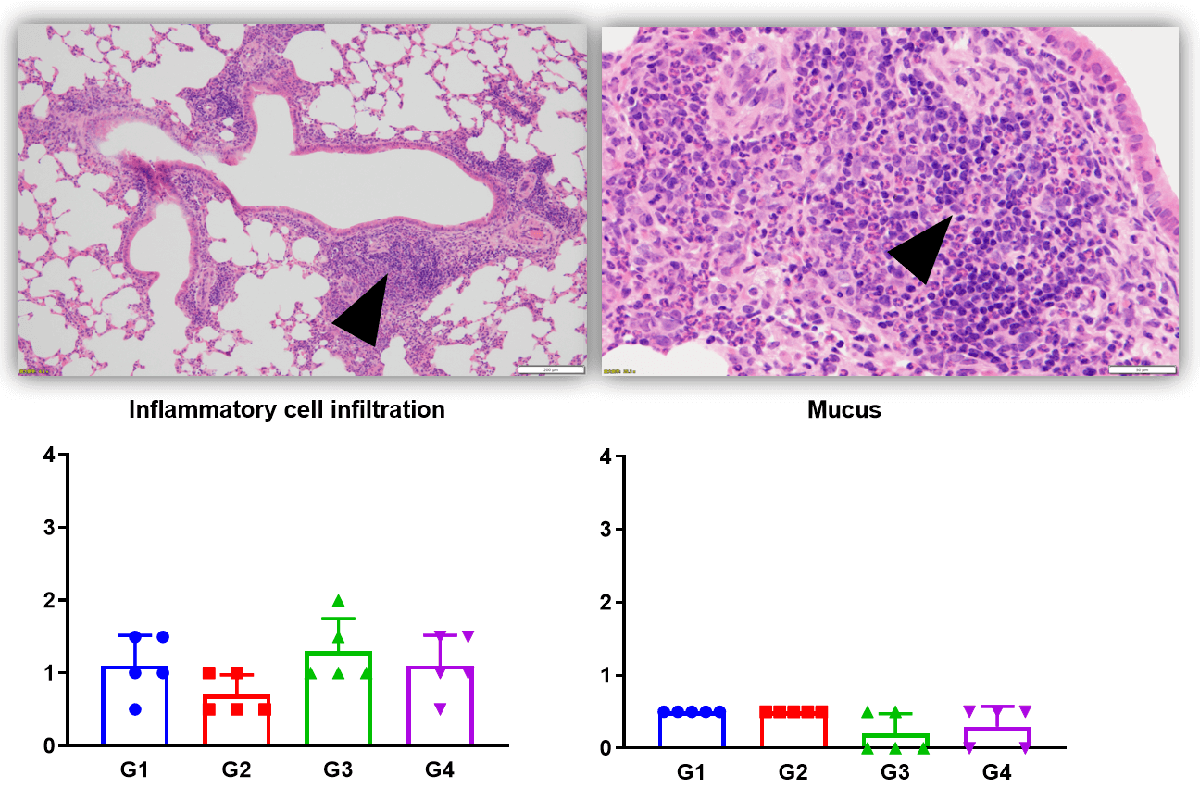
哮喘的主要特征:
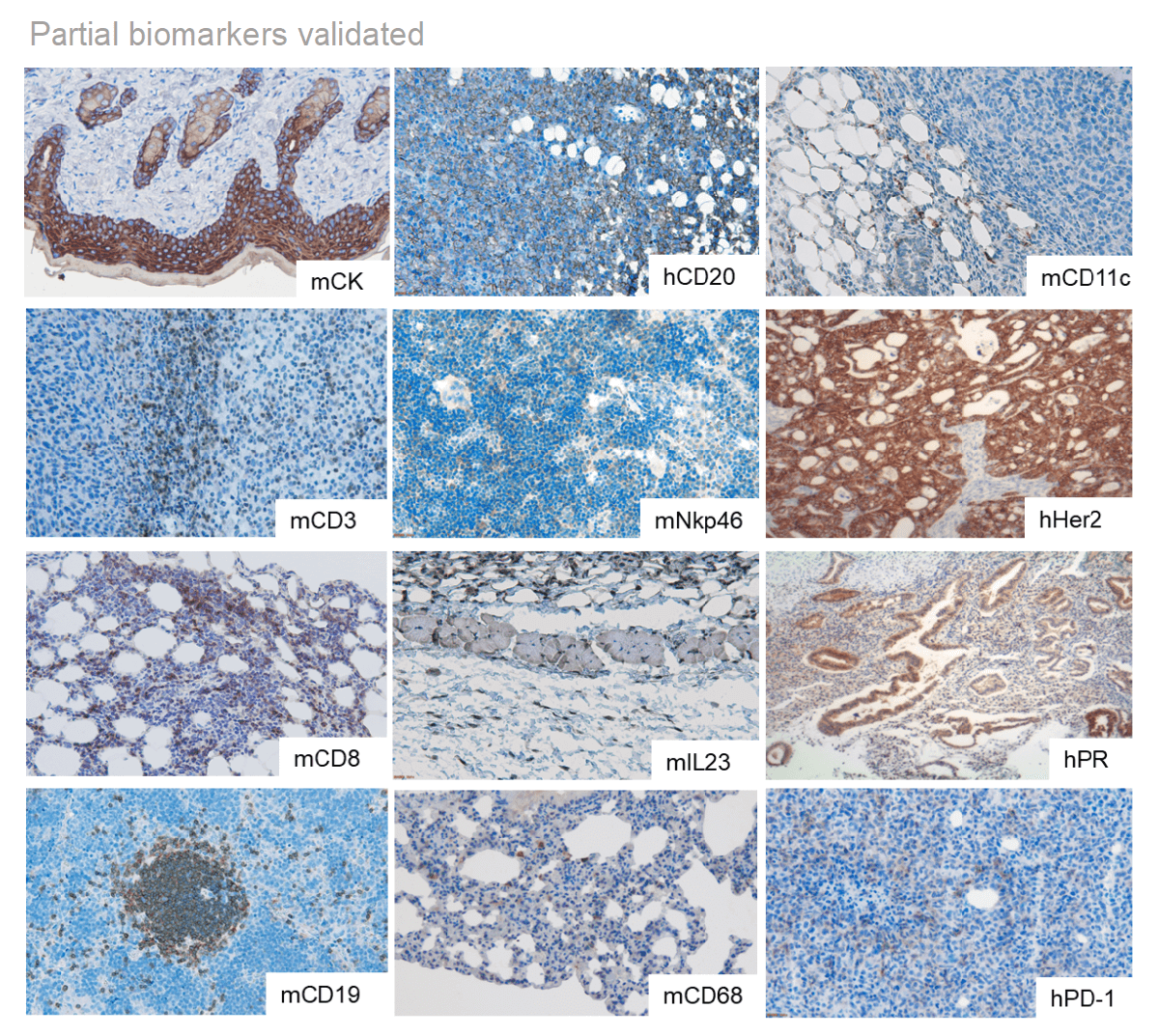
可用的病理分析:
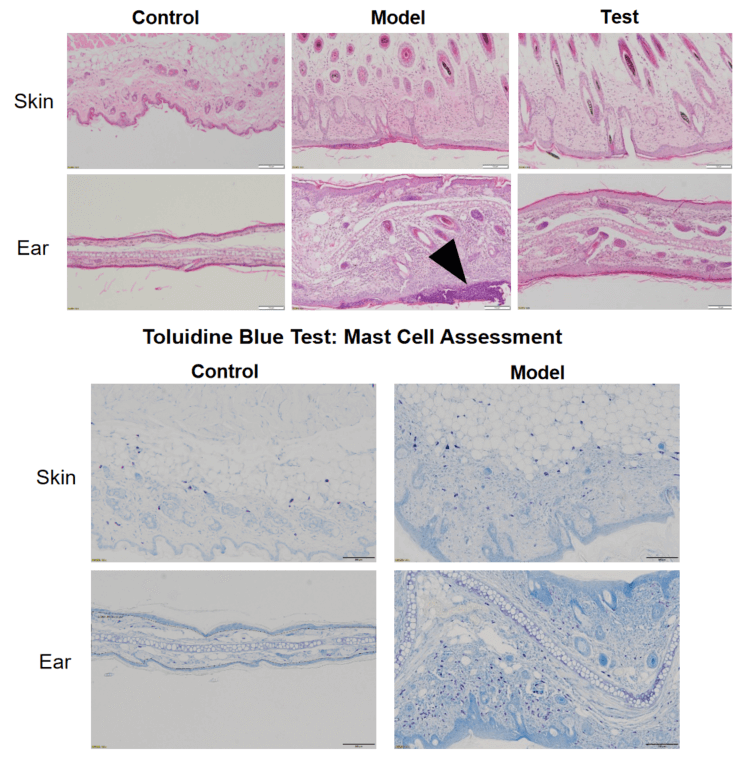
HE染色-银屑病皮肤组织中的炎症
HE染色-特应性皮炎皮肤组织中的炎症
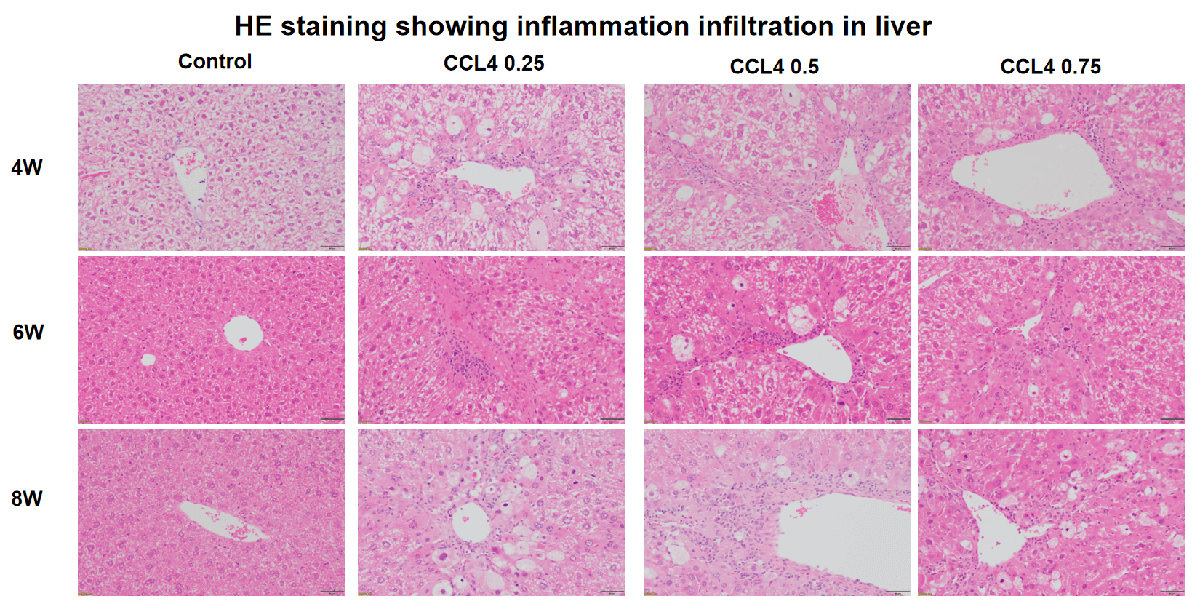
非酒精性脂肪性肝炎(NASH)的主要特征:
NASH是NAFLD的一种形式,除了肝脏脂肪外,还伴有肝脏的肝炎性炎症和肝细胞损伤。炎症和肝细胞损伤可能导致肝纤维化或肝脏瘢痕形成。NASH还可能导致肝硬化或肝癌。
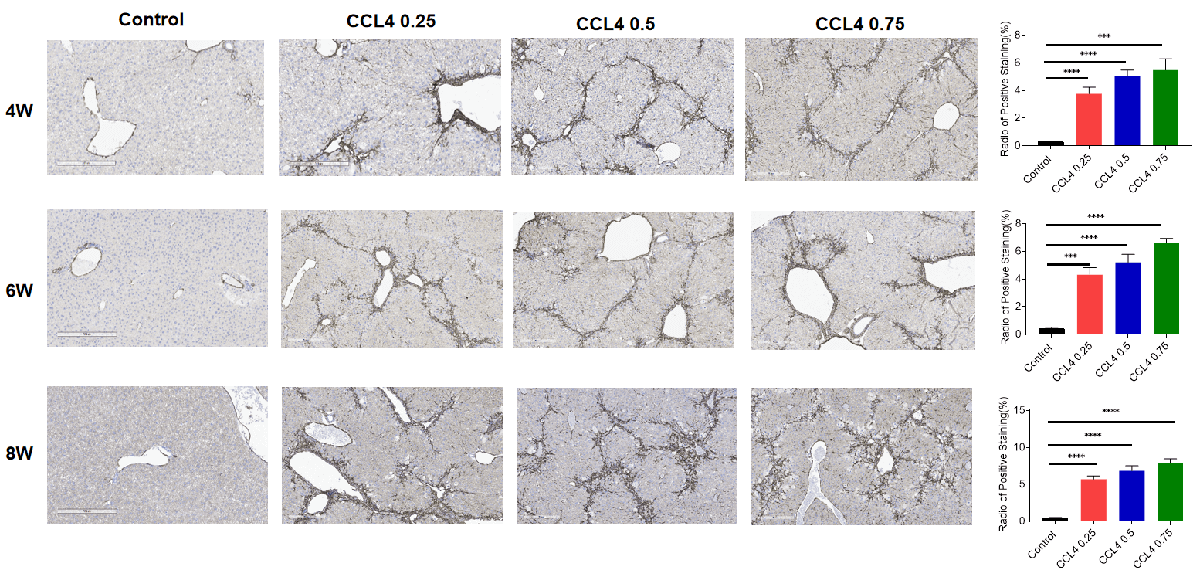
免疫组化显示肝脏中的成纤维细胞标记物α-SMA
IBD的主要特征:
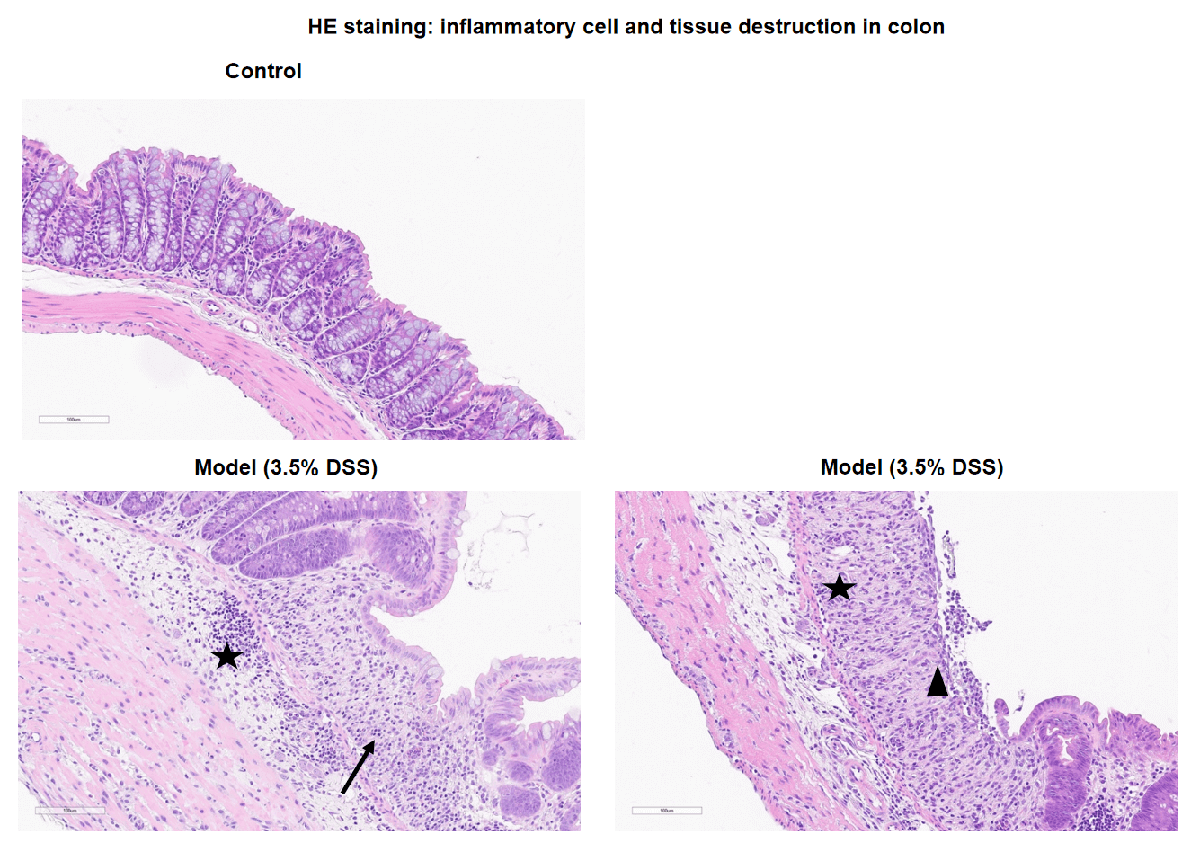
备注:在对照组小鼠的结肠中未观察到显著的病理变化。在DSS诱导的模型组中,结肠显示隐窝丧失、溃疡形成和混合炎症细胞浸润。黑色箭头表示隐窝丧失,黑色三角形表示粘膜层的溃疡形成,黑色星号表示炎症细胞浸润。
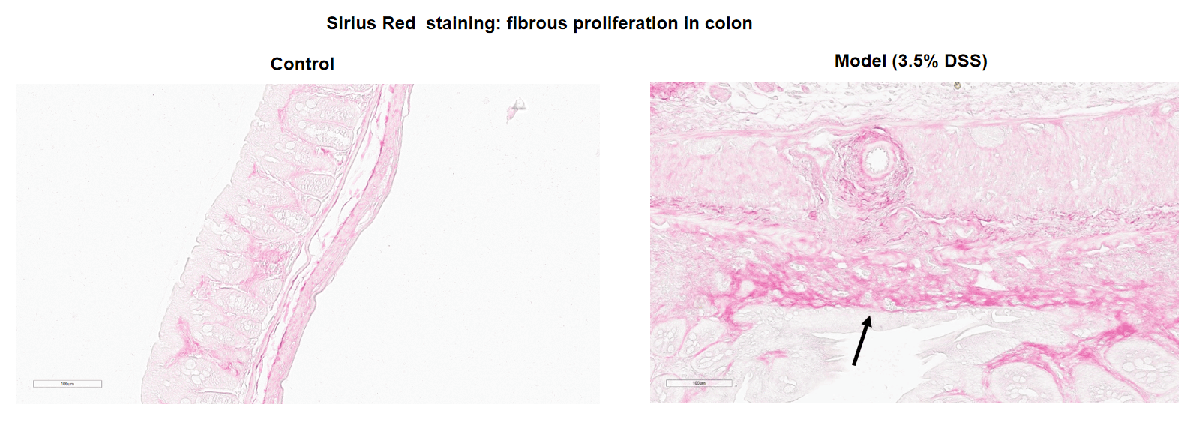
备注:在对照组小鼠的结肠中未观察到显著的病理变化。在DSS诱导的模型组中,观察到结肠中的纤维增生。黑色箭头表示纤维增生。
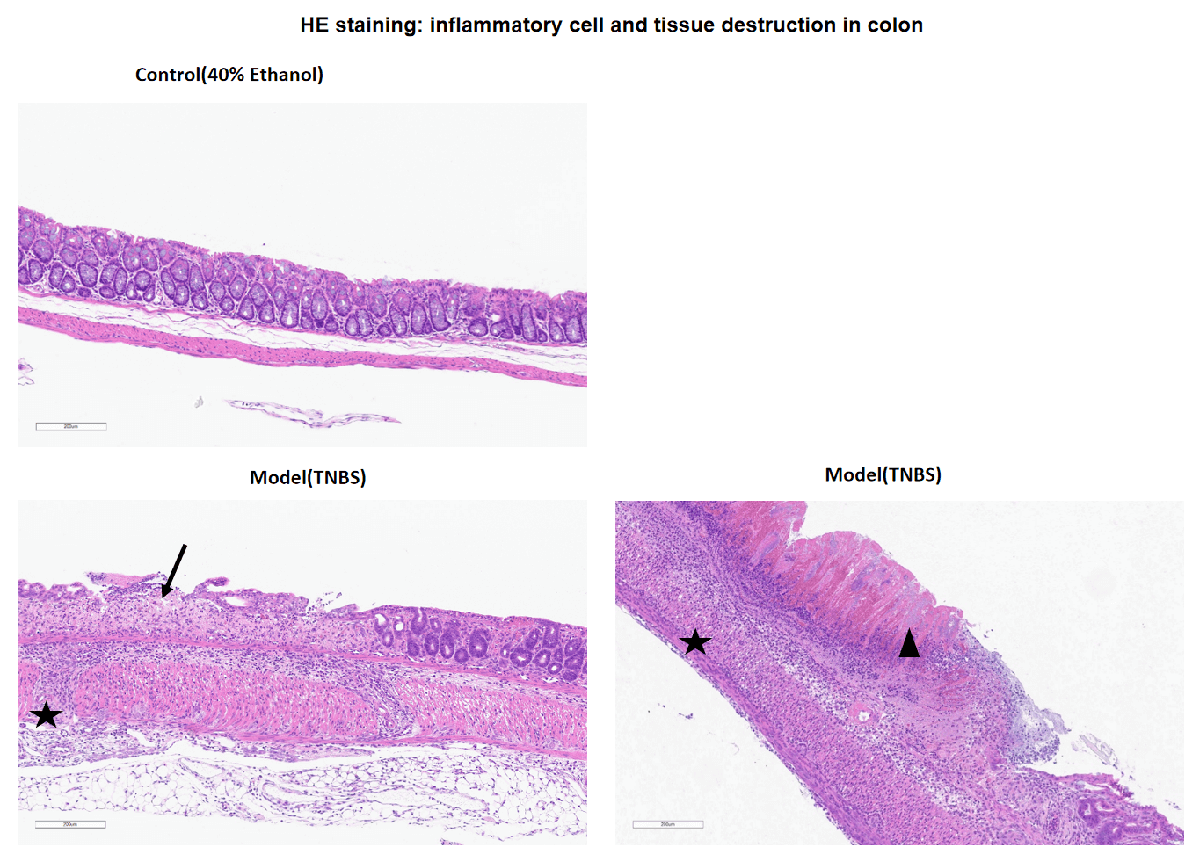
备注:在对照组小鼠结肠中未观察到显著的病理变化,40%乙醇灌注后也无显著变化。在TNBS诱导的模型组中,观察到结肠中溃疡形成、全层炎症和肠道坏死。黑色箭头表示粘膜层的溃疡形成,黑色三角形表示肠道坏死,黑色星号表示全层炎症。
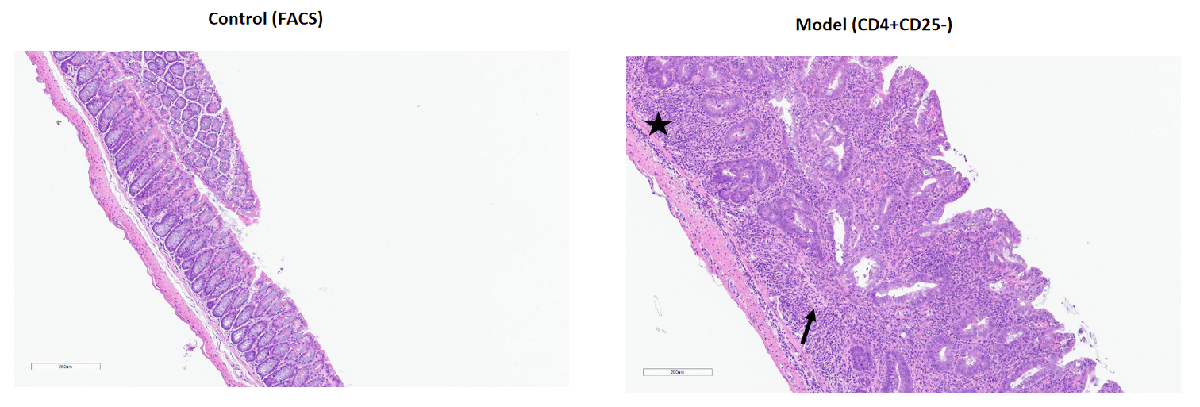
备注:在FACS对照组小鼠的结肠中未观察到显著的病理变化。在CD4+CD25–过继性转移模型组中,观察到结肠中的隐窝丧失和炎症细胞浸润。黑色箭头表示隐窝丧失,黑色星号表示炎症细胞浸润。
CIA的主要特征:
CIA是最广泛研究和使用的类风湿性关节炎(RA)动物模型。CIA模型与RA相似的病理特征包括增生性滑膜炎,伴有多形核细胞和单核细胞的浸润、软骨破坏、骨吸收、滑膜赘生物形成和纤维化。
HE染色:炎症细胞浸润,软骨破坏,骨吸收和滑膜赘生物形成
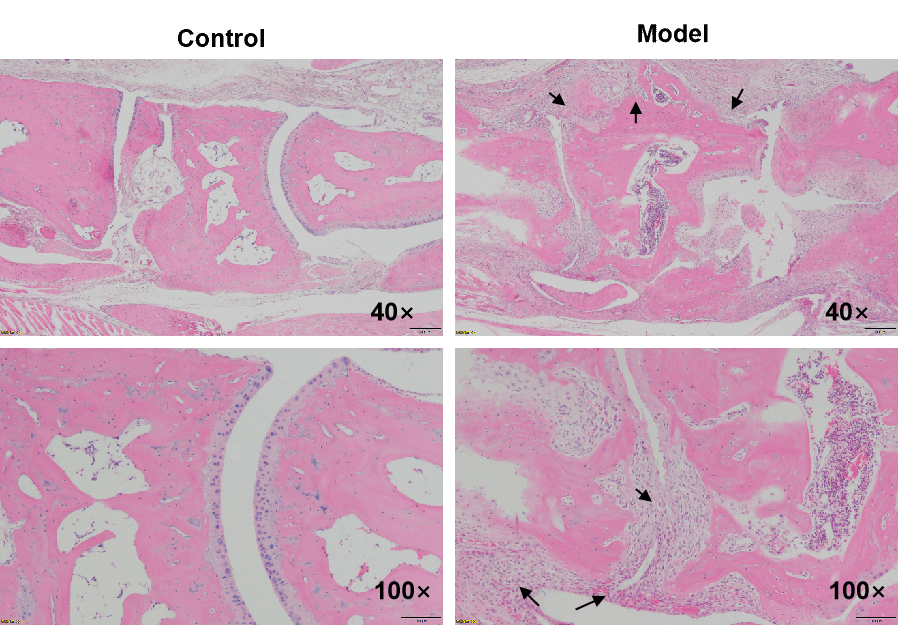
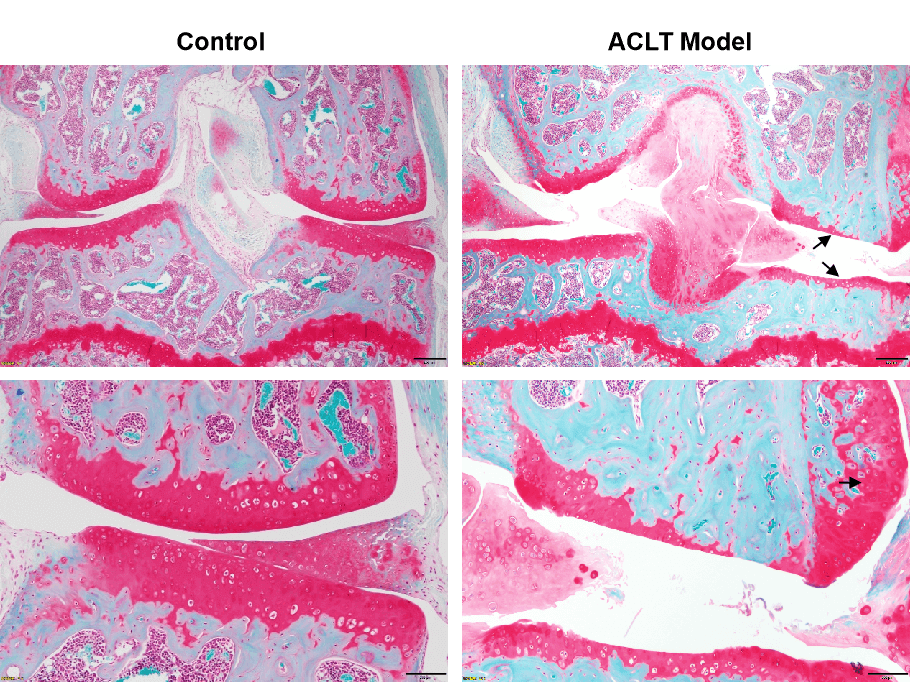
外科诱导OA模型的主要特征:
OA的外科诱导方法通过关节不稳定、关节力学改变和关节内炎症的组合来发挥作用。前交叉韧带切断(ACLT)模型由于前交叉韧带损伤引起关节不稳定,继而导致创伤后骨关节炎(PTOA)。小鼠ACLT诱导的OA模型具有许多特征,如软骨破坏、骨赘形成和滑膜变化。
番红-O和固绿染色显示软骨破坏
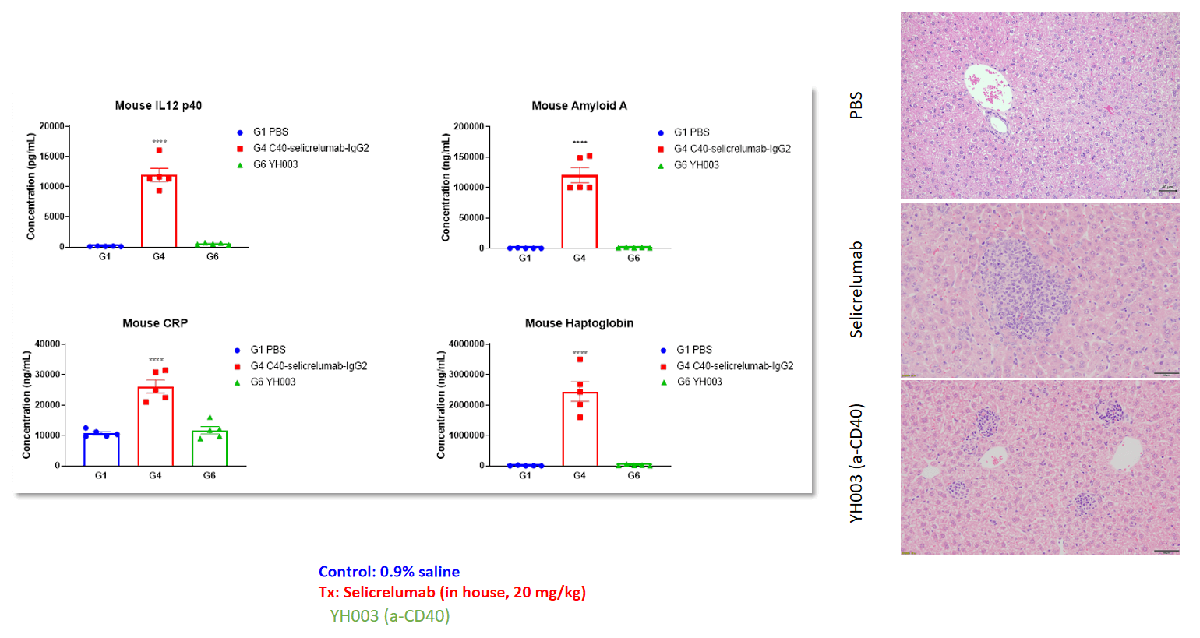
临床前毒理学研究主要集中在药物安全性评估上。药物是否安全有效是药物开发的决定性因素,毒性/安全性问题是整个药物开发过程中研究中止的主要原因。临床前毒理学研究是通过研究药物暴露与毒性反应之间的关系,为人类临床试验提供可靠的毒代动力学基础,解释可能的毒性靶器官和毒性反应,并预测药物在人体中的安全性。
团队介绍
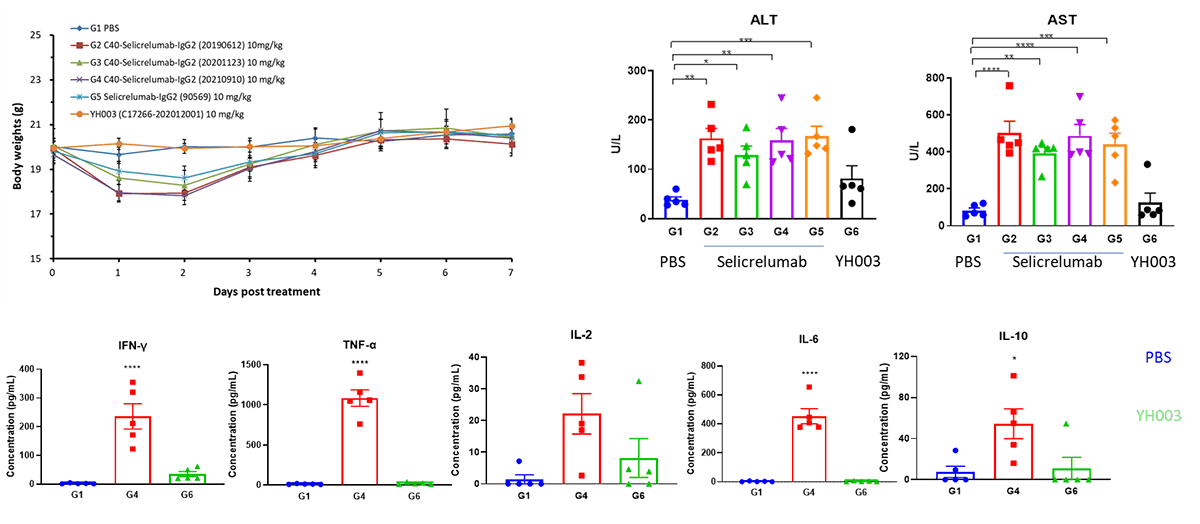
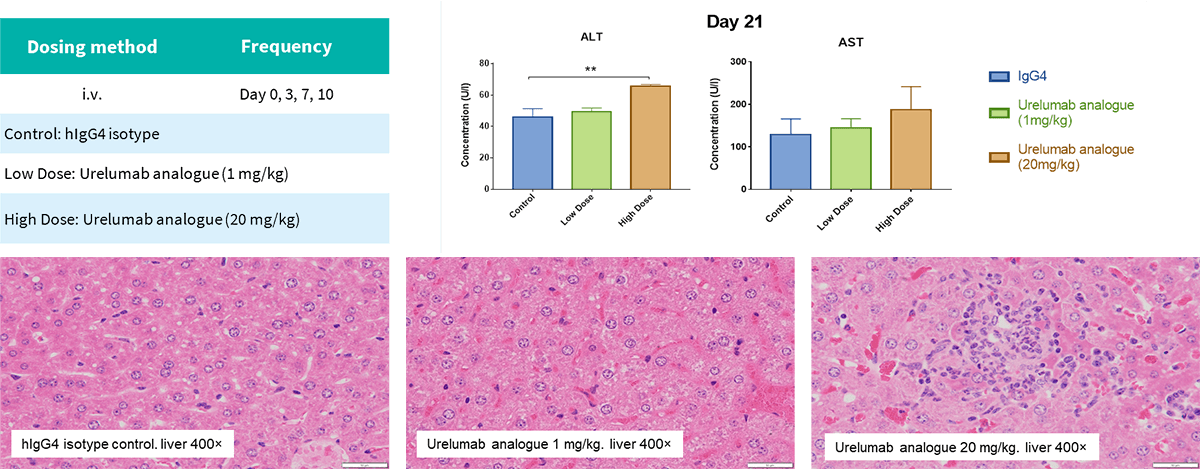
Selicrelumab(类似物)在B-hCD40人源化小鼠中的急性期蛋白质增加和肝损伤反应
在人源化B-hSIRPa/hCD47小鼠中的贫血和网织红细胞增多症
在高剂量Hu5F9治疗的早期,红细胞和血红蛋白暂时减少,随后恢复至正常水平。
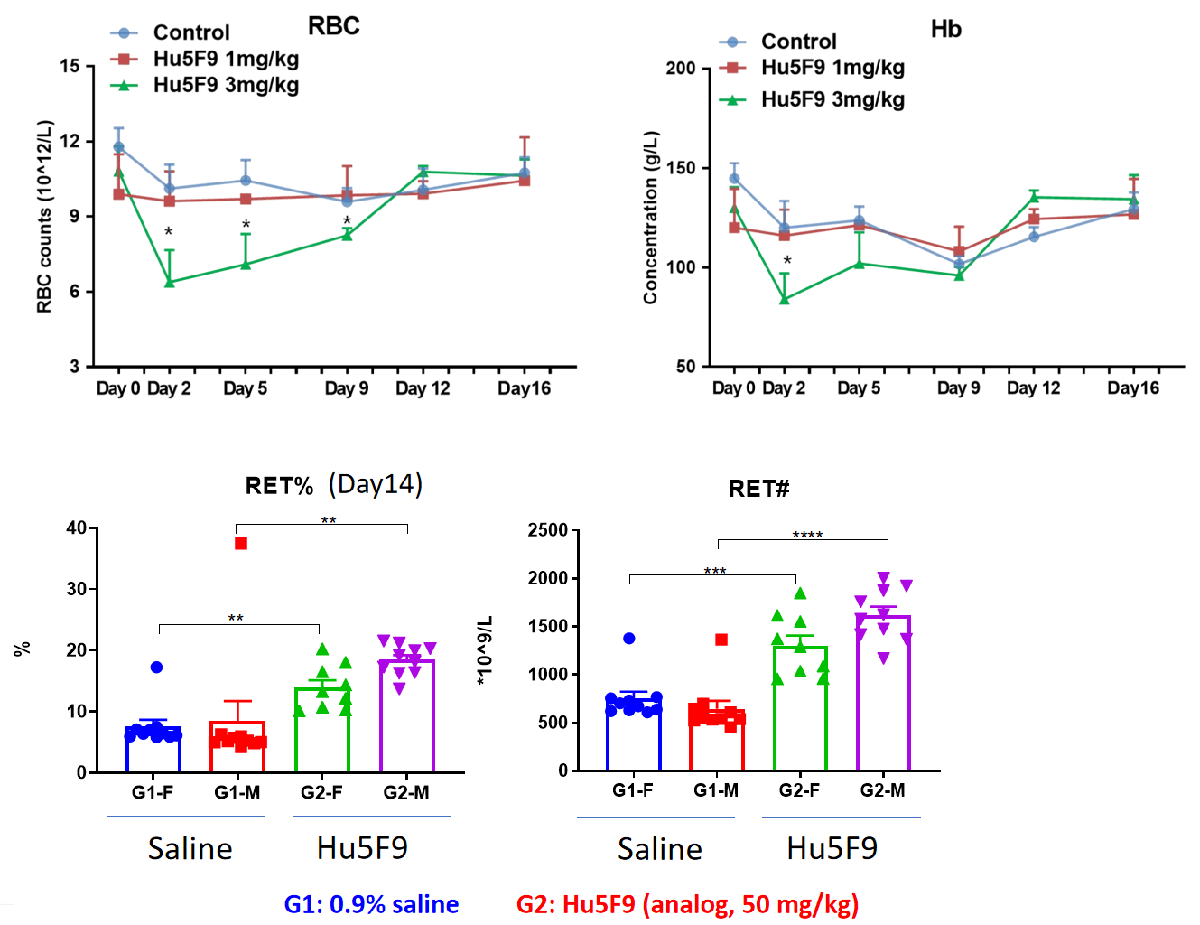
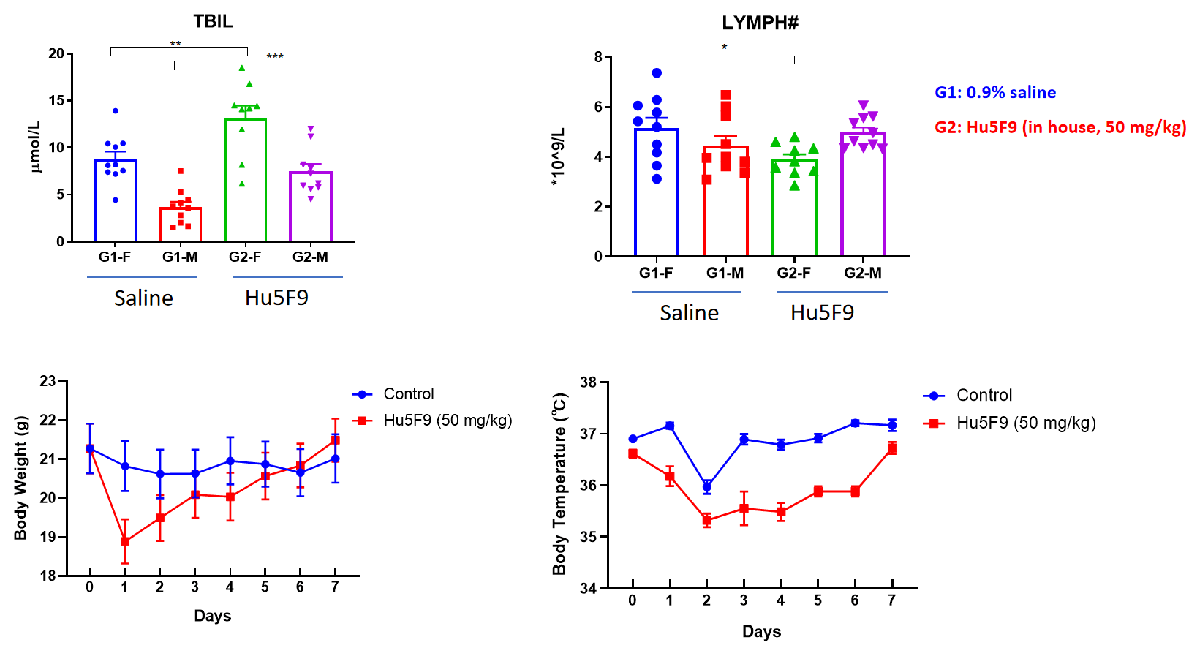
在人源化B-hSIRPa/hCD47小鼠中的高胆红素血症、淋巴细胞计数下降和寒战
| Popular Humanized Animal Models For Toxicology Research | ||||
| B-hPD-1 mice | B-h4-1BB mice | B-hPD-1/h4-1BB mice | B-hPD-1/hPD-L1/h4-1BB mice | B-hCCR8 mice |
| B-hLAG3 mice plus | B-hPD-1/hLAG3 mice | B-hCD155 mice | B-hCD6 mice | B-hGLP1R mice |
| B-hCD38 mice | B-hCD147 mice | B-hCD16A mice | B-hCD98HC mice | B-hGCGR mice |
| B-hCD40 mice | B-hCTLA4 mice | B-hGITR mice | B-hTIGIT mice | B-hTSLP/hTSLPR mice |
| B-hCD3E mice | B-hCD3E/hCD38 mice | B-hCD3E/hCD28 mice | B-hCD3E/h4-1BB mice | B-hTNFR2 mice |
| B-hCD3EDG mice | B-hFcRn mice | B-hSIRPA/hCD47 mice | B-hGARP mice | B-hTFR1 mice |
| B-hIL4/hIL4RA mice | B-hIL17A/hIL17F mice | B-hIL36R mice | B-hTNFA mice | B-hRANKL mice |
| B-hIL2RA mice | B-hIL2RB/IL2RG mice | B-hIL13 mice | B-hIL1RAcP mice | B-hIL10RA/IL2RG mice |