在此页面上
药物药效和安全性的机制和功能性数据对于提交药物IND申请至关重要。我们的科学家提供定制化的专业研究设计,旨在满足您的药物开发需求。
药效学(PD)服务包括:
药代动力学(PK)服务包括:







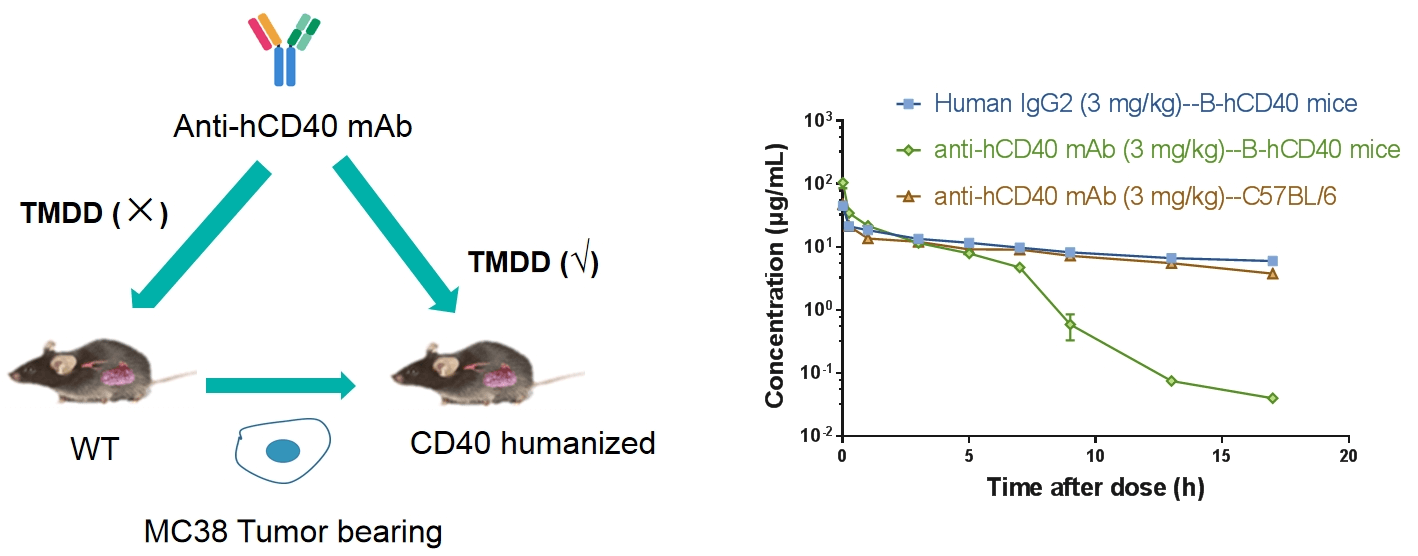
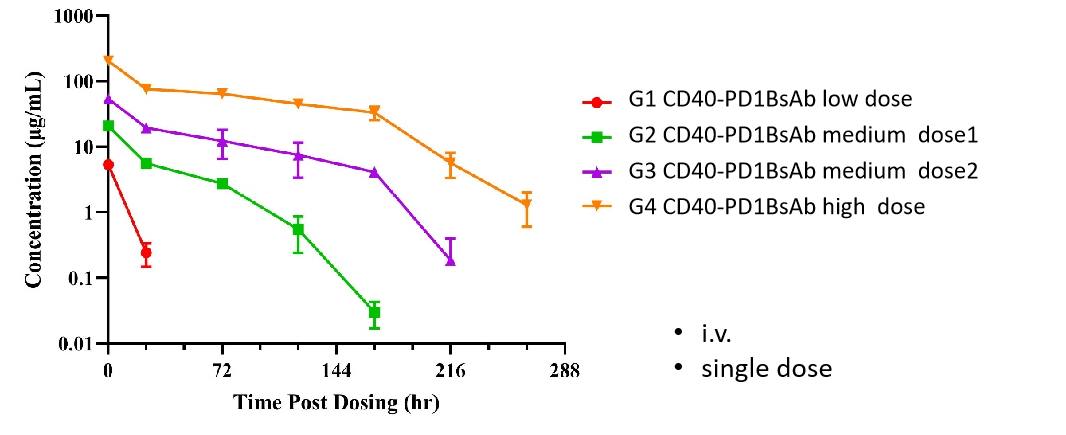
受体占有率(RO)是抗体药物开发中的关键药效学指标。RO分析评估测试药物在不同时间点、不同剂量下与特定细胞上的靶标结合情况。通过将RO数据与药代动力学和药效数据结合,研究人员可以更好地理解剂量-反应关系。流式细胞术是我们进行受体占有率研究的主要方法,使用竞争性抗体、非竞争性抗体和抗药物荧光二抗。通过检验不同的检测条件,我们测量自由受体、结合受体和总受体的信号,从而精确计算受体占有率。
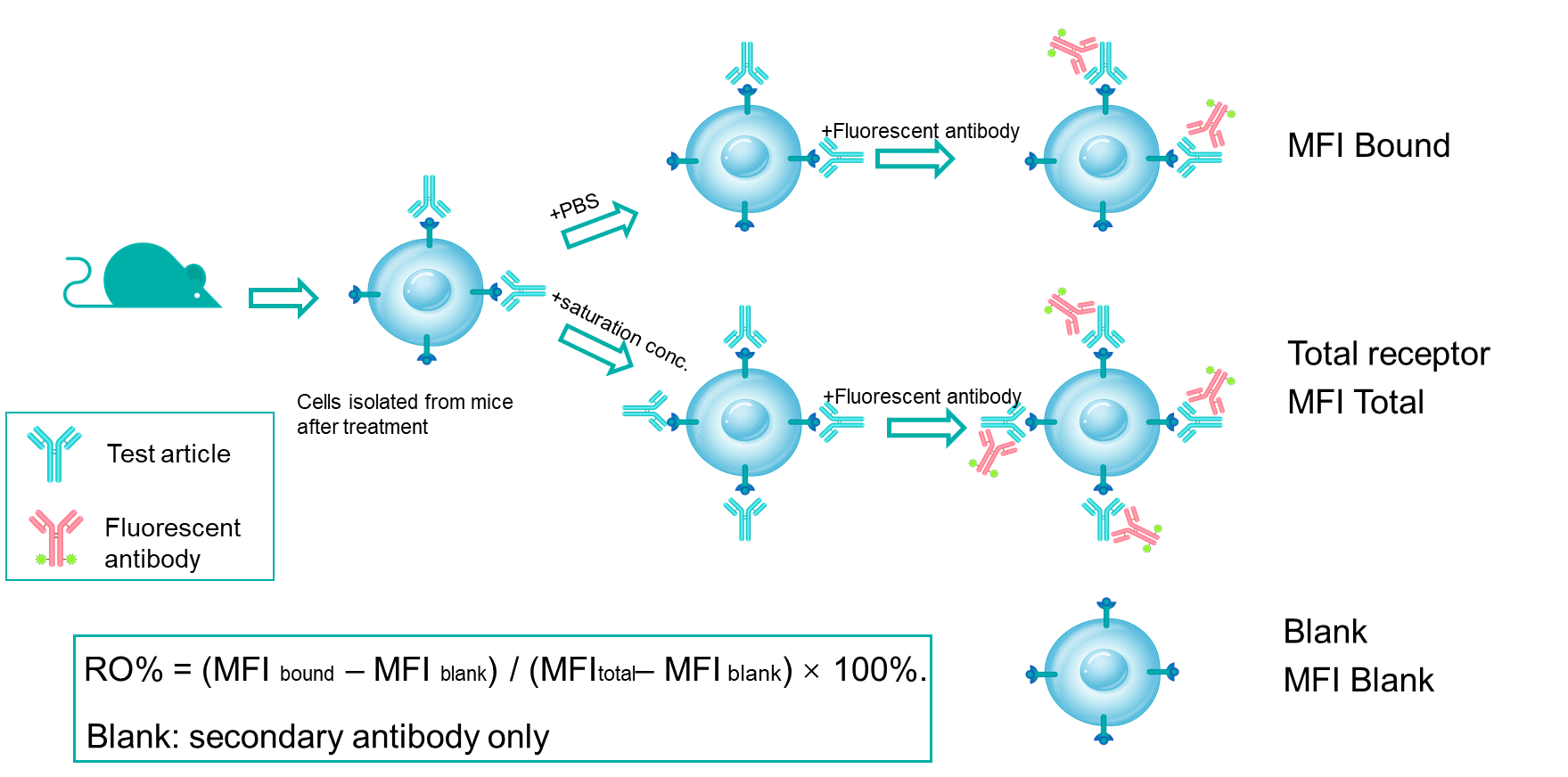
RO%分析机制
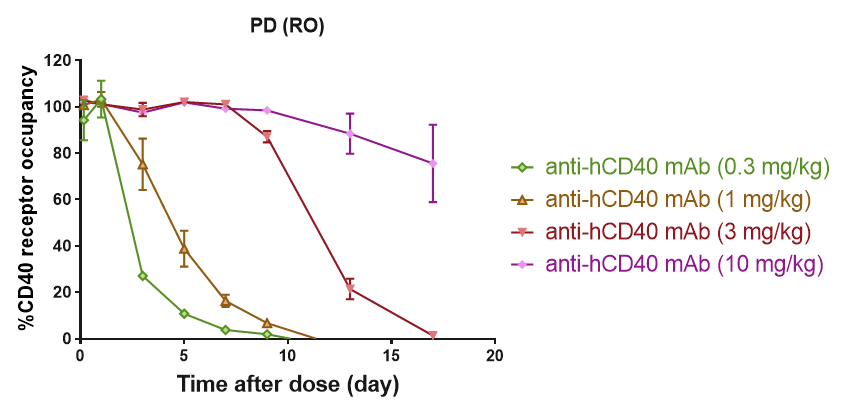
在B-hCD40小鼠外周血CD19+ B细胞上进行CD40抗体的受体占有率检测。人源化B-hCD40小鼠接受不同剂量的抗人CD40抗体处理,通过流式细胞术评估外周血B细胞上受体占有率的百分比。
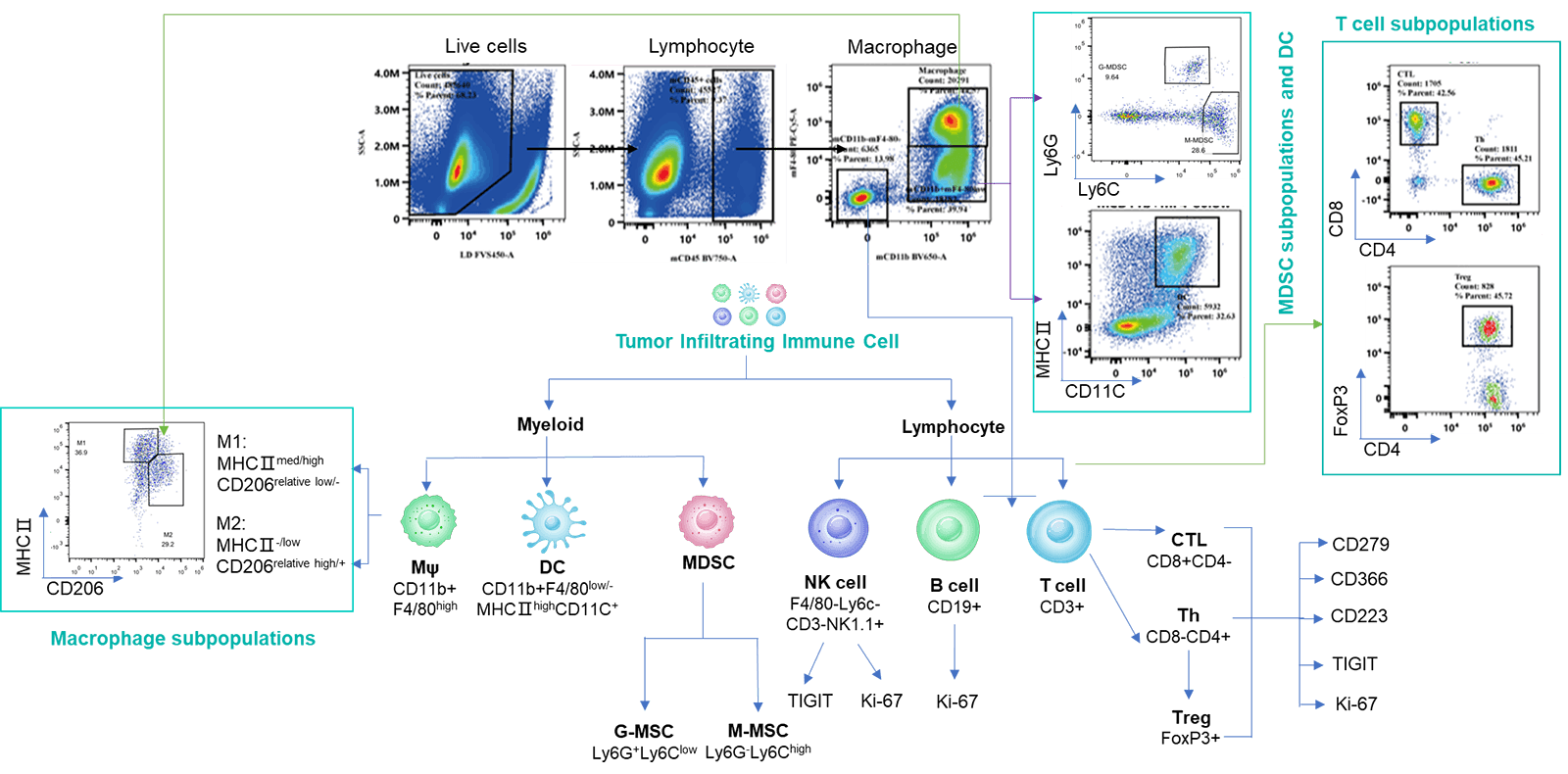
分析肿瘤浸润免疫细胞对于理解药物对肿瘤免疫微环境的调节作用至关重要。通过多参数流式细胞术,我们可以全面评估肿瘤内各种免疫细胞亚群的浸润水平及其激活或抑制状态。为了获得更深入的洞察,我们还采用多色免疫荧光和免疫组织化学(IHC)研究,分析免疫细胞的浸润情况及其在肿瘤组织切片中的空间分布。这些方法为阐明差异化肿瘤免疫疗法的作用机制提供了关键数据。
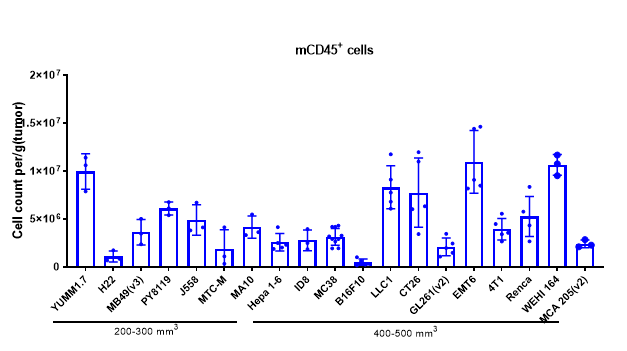
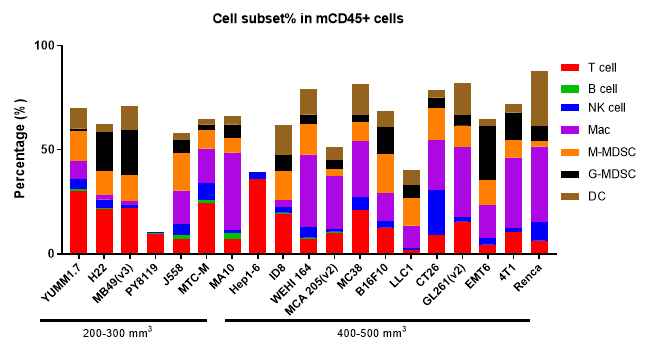
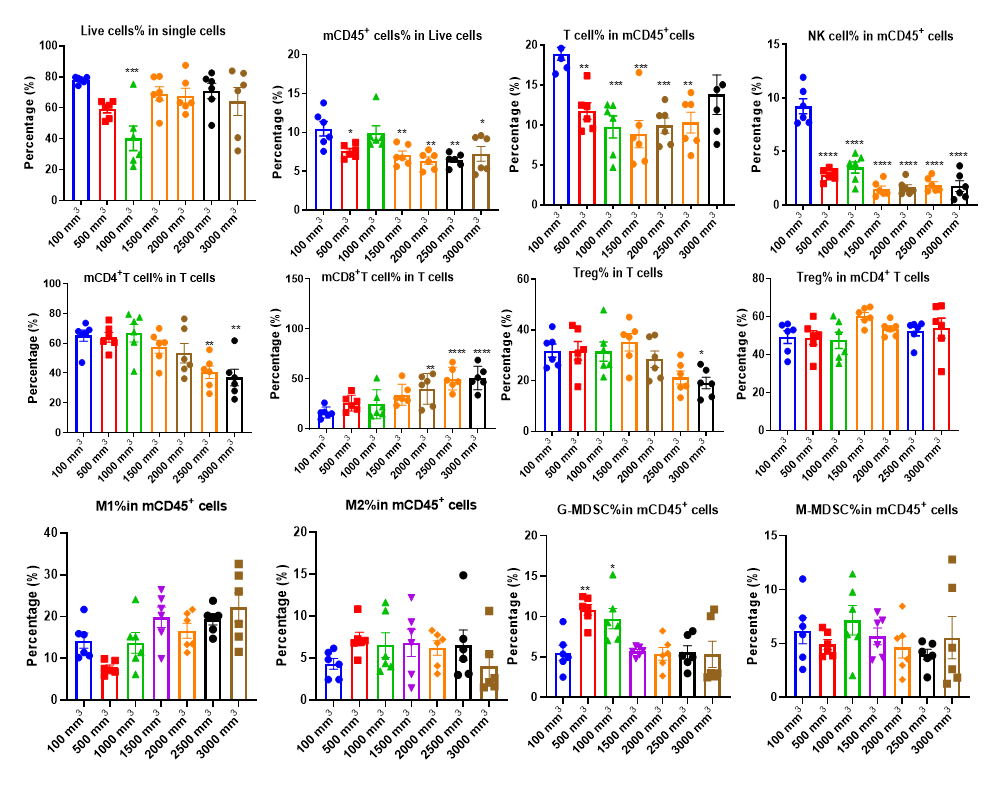
不同体积MC38肿瘤中各种免疫细胞的浸润数据以Mean±SEM表示,并采用单因素方差分析(One-way ANOVA)进行分析,与100 mm3比较。
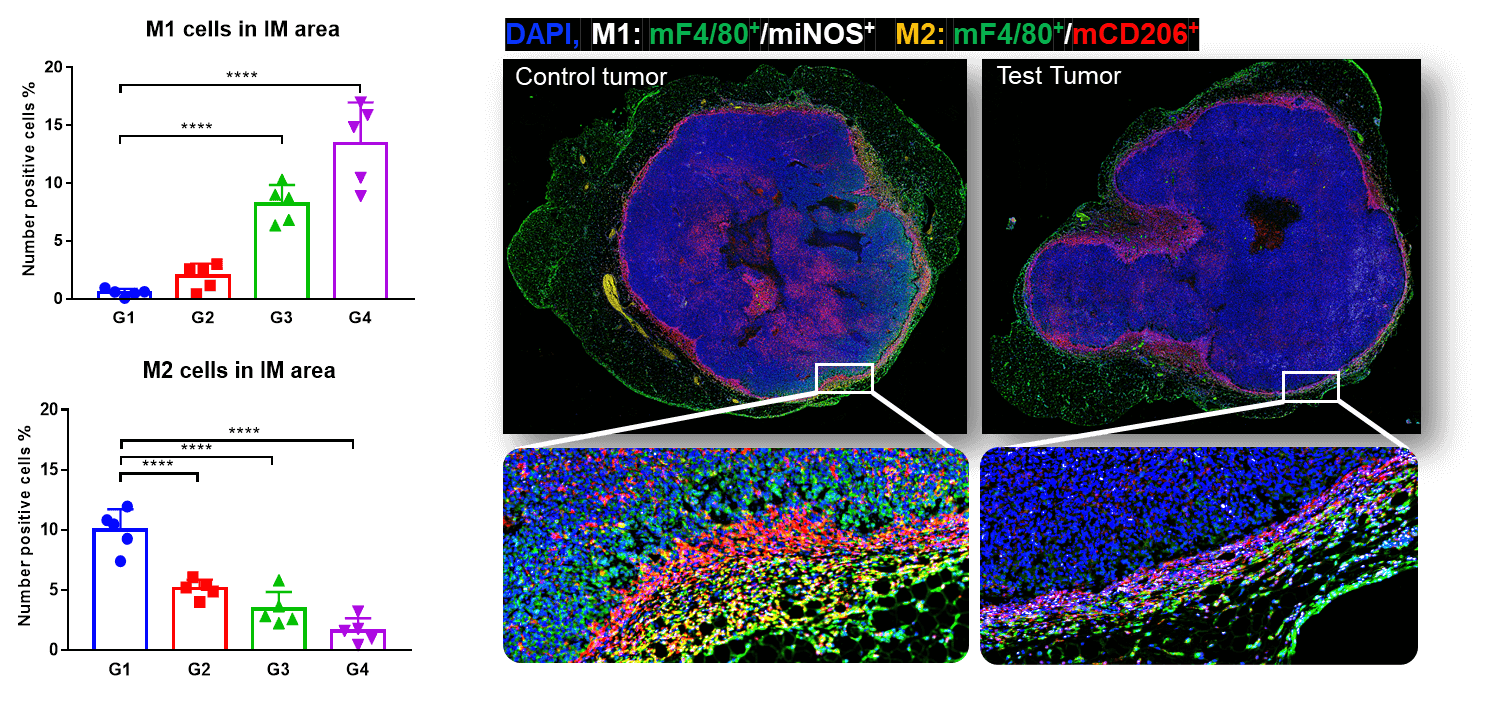
肿瘤组织的四重免疫荧光全切片扫描及M1和M2在侵袭边缘的共定位。研究发现,MC38肿瘤的侵袭边缘M1显著增加,而M2在帕博利珠单抗治疗下显著下降,且呈剂量依赖性。这表明M1浸润促进了抗PD-1介导的肿瘤生长抑制。
TMA染色显示,CD8+ T(CTL)细胞在Test的肿瘤侵袭边缘和肿瘤中心区域明显增加。这与M1/M2比值的增加有关。
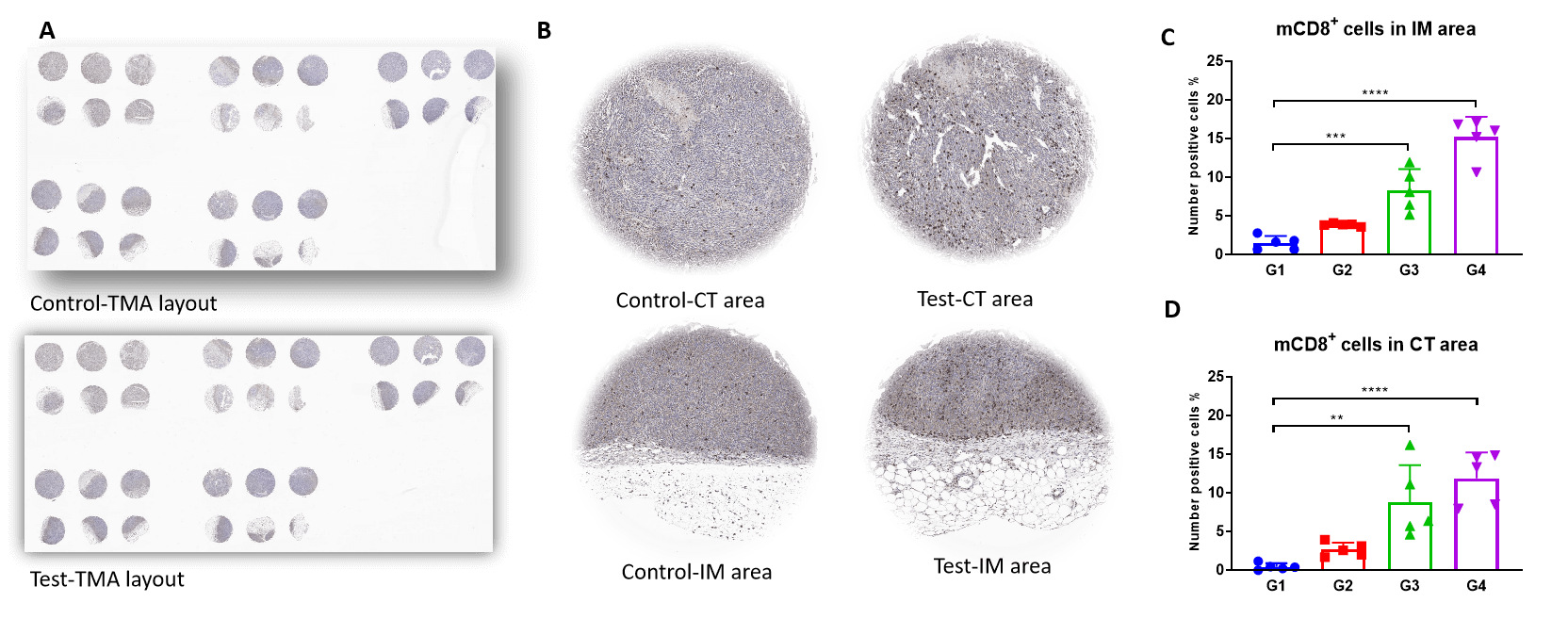
肿瘤中心和侵袭边缘的mCD8+ T细胞组织微阵列IHC染色
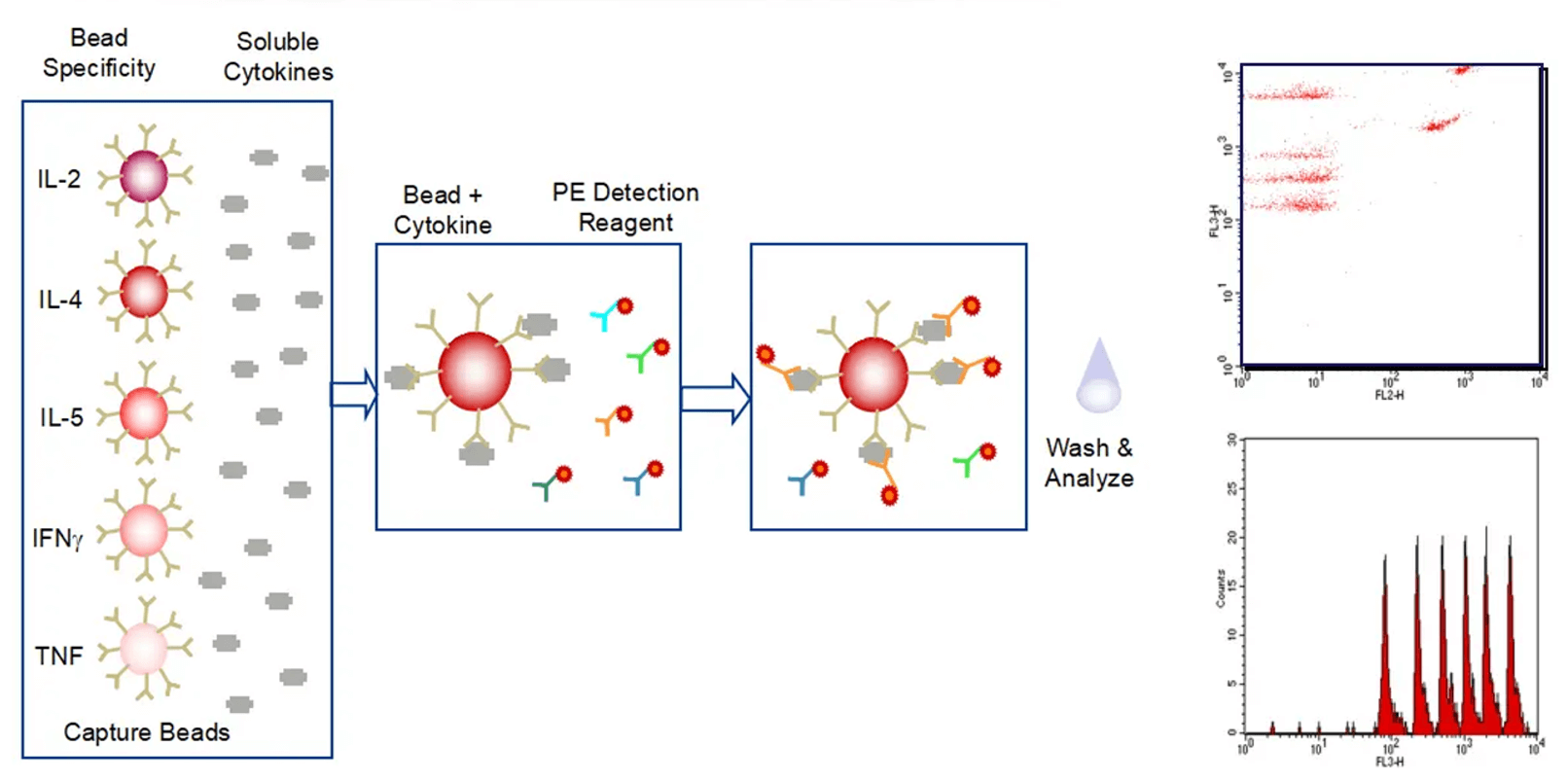
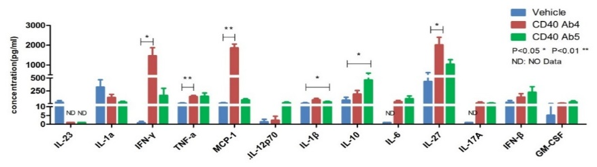
细胞因子分析作为免疫治疗、免疫相关疾病和免疫相关毒性的研究中的重要生物标志物。我们利用ELISA、Luminex和MSD平台对细胞上清液、血清、组织液和组织匀浆样品进行单一或多重细胞因子分析,支持肿瘤和自身免疫性疾病的药理药效研究,以及细胞因子风暴等毒理学研究。
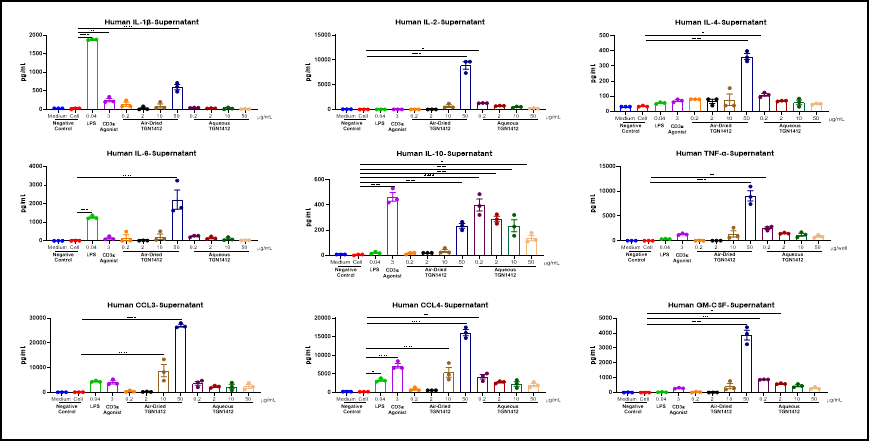
风干TGN 1412在体外可诱导PBMC的炎性因子风暴
百奥赛图拥有丰富的临床前药代动力学(Pharmacokinetics,PK)检测和生物分析经验,可提供基于抗体药物的专业药代动力学分析服务。PK生物分析平台包括ELISA和ECL。
虽然与传统的化学药物有很大的不同,抗体的药代动力学研究仍然基于经典的药代动力学研究方法,但更多的是关注其靶向性以及受抗体特性影响的药代动力学特性。我们有两种实验类型:抗体血清/血浆浓度检测和抗药物抗体(ADA)筛选试验。
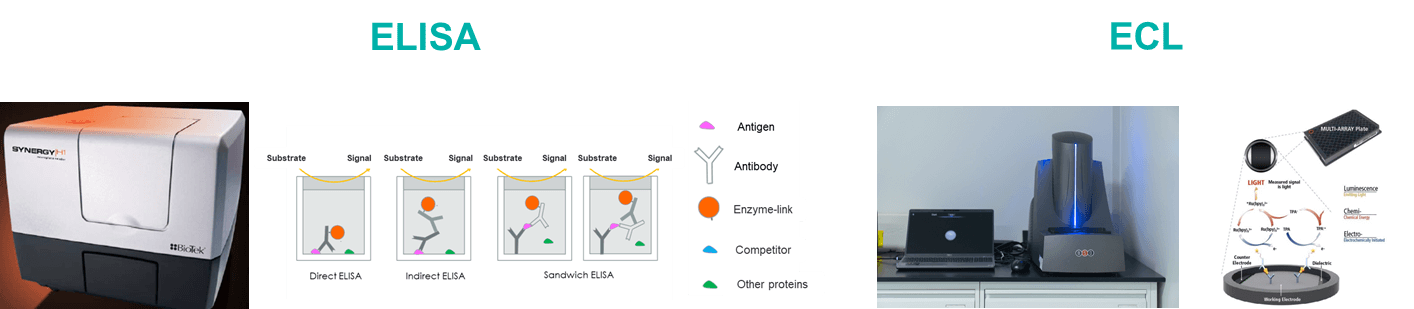
| ELISA | ECL | |
| Plates | Ordinary microporous plate | Graphite electrode microplate |
| Reaction Principle | Catalytic substrate luminescence after antigen antibody binding | Electrochemiluminescence after antibody antigen binding |
| Instrument | BioTek H1/EPOCH2 microplate reader | MSD |
| Advantage | Low cost; High flux; More experience | High sensitivity; High flux; Multi-factor detection; Low sample volume |
| Dynamic range | 2-3 logs | 3-5 logs |
| Purpose | Bioanalytical method validation; Quantitative detection; ADA | |
| Sample Type | Serum or plasma of mice, rats, dogs, monkeys, human, etc; Tumor; Brain tissue; Cerebrospinal fluid. | |
| Drug Type | Monoclonal antibody, Bispecific antibody, ADC, Fusion protein, etc. | |
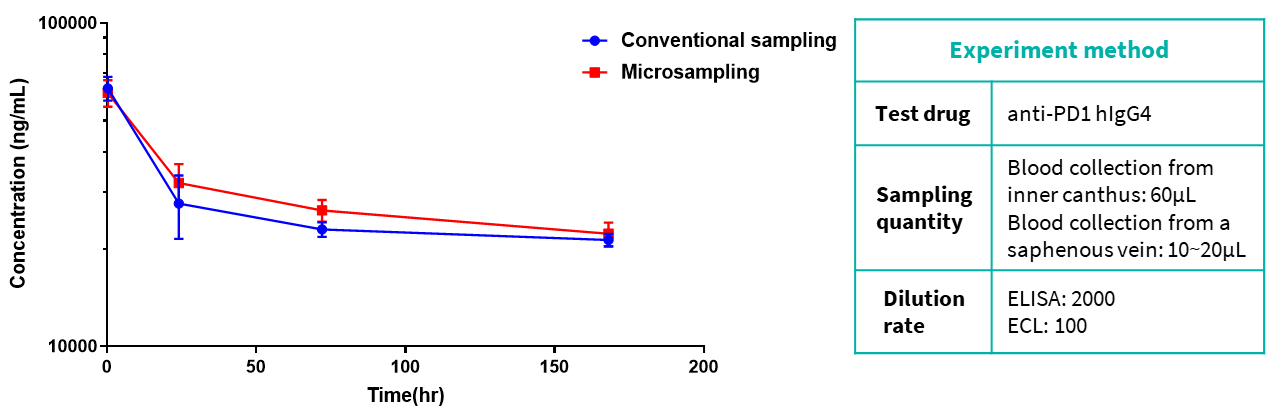
数据显示,两种采样方法的实验结果没有明显差异。
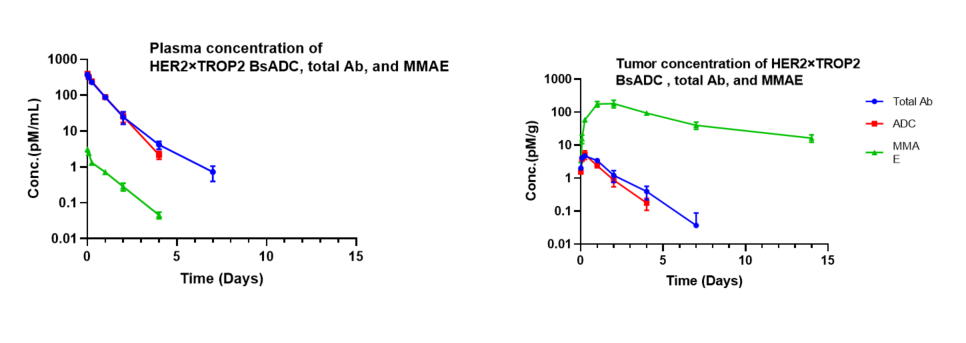
在NCI-H1975异种移植模型中对HER2×TROP2 BsADC进行药代动力学分析。单次给药3 mg/kg的HER2×TROP2 BsADC后,发现有效载荷MMAE在肿瘤中积累,但在血浆中的浓度较低。这表明,HER2×TROP2 BsADC已实现MMAE的有效肿瘤靶向递送,并且可能具有更好的抗肿瘤活性。
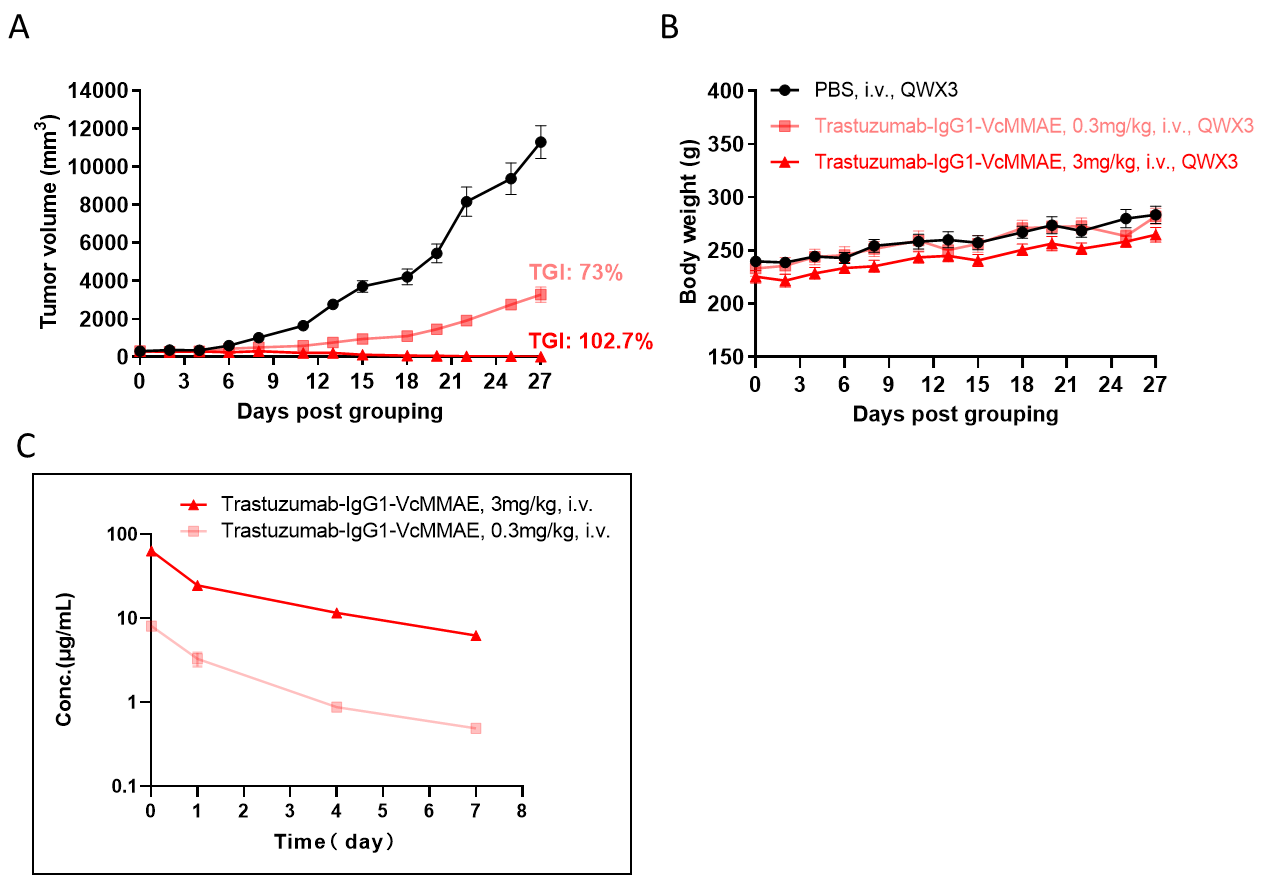
ADC在B-SDG大鼠中的抗肿瘤活性。(A)ADC(Trastuzumab-IgG1-VcMMAE)抑制了NCI-H1975肿瘤在B-SDG大鼠中的生长。人非小细胞肺癌细胞(5E6)被皮下植入B-SDG大鼠(雌性,8周龄,n=6)。当肿瘤体积达到约300-400 mm3时,对大鼠进行分组,并按图中所示的剂量进行ADC治疗。(B)治疗过程中体重变化。(C)最后一次治疗后的ADC PK检测。如图A所示,ADC可以显著抑制B-SDG大鼠肿瘤生长,证明B-SDG大鼠为ADC的体内评估提供了一个强大的临床前模型。数据以平均值±SEM表示。
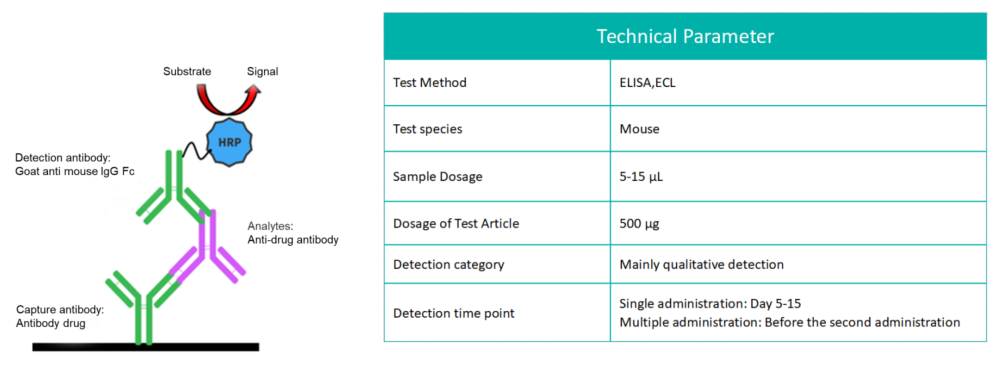
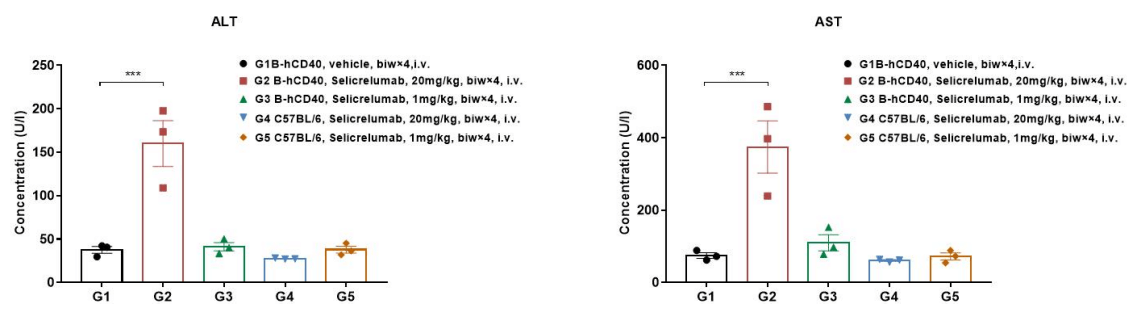
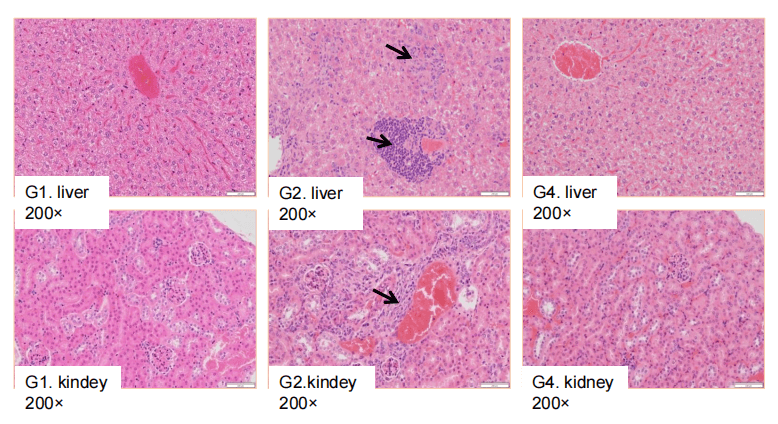
在生物制品治疗过程中,某些生物体可能会产生免疫反应,最显著的是产生抗药物抗体(ADA)。免疫原性是指某种物质引发免疫反应的能力。ADA-单克隆抗体(mAb)免疫复合物的形成为单克隆抗体提供了额外的清除途径,显著影响其治疗效果和体内的清除过程。
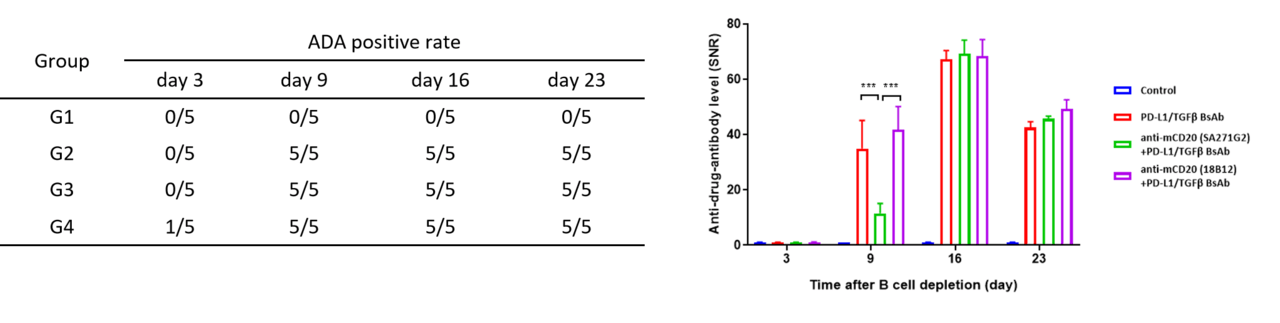
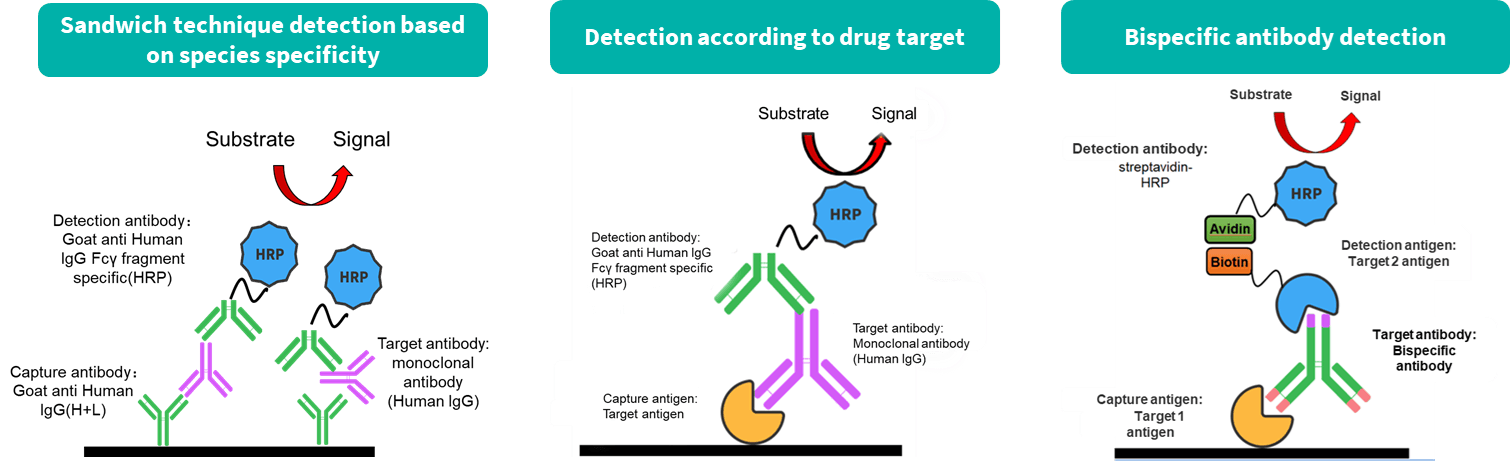
常用的ADA检测方法利用ADA与药物的特异性结合特征来检测在小鼠体内产生的ADA(实质上是小鼠抗人IgG)。