在此页面上
抗体偶联药物(Antibody–drug conjugates, ADCs)是一类新型治疗生物药物,由可识别特异性肿瘤抗原的单克隆抗体、高效细胞毒性药物(即“有效载荷”),以及连接抗体与有效载荷的连接子组成,旨在利用单克隆抗体的特异性,将强效的细胞毒药物选择性地传递到抗原表达的肿瘤细胞中。近年来,ADCs被认为是未来疾病治疗的重要方向,正在全球范围内掀起研发热潮。
依托强大的体内外药理药效平台,我们建立了先进的ADC评价体系,可用于研究单抗ADC(McAb-ADC)和双抗ADC(BsAb-ADC)的临床前研发,包括其药效、作用机制及功能效应评估,并探索与其他抗肿瘤疗法的联合用药策略。
我们的流式细胞术平台与细胞实验平台可快速、可靠且高度重复地支持多种体外研究,包括抗体亲和力与结合力评估、抗体内吞过程分析、有效载荷的细胞毒性作用(如细胞凋亡与细胞周期变化)、以及抗体片段介导的效应功能检测(ADCC、CDC、ADCP)等。在体内研究方面,我们经验丰富的团队结合丰富的CDX模型资源,可高效开展ADC及其联合用药方案的药效评估。此外,我们还建立了一系列肿瘤相关抗原(TAA)靶点人源化小鼠模型,可用于ADC的毒理学研究。同时,我们还擅长定制抗原特异性的过表达或敲入细胞系,以支持针对特定靶点的ADC药物开发。
| Projects | Experiments | Methods | ||
| Binding Assays | Target Antigen Binding (Same Family) | Binding activity detection | SPR/BLI | OK |
| Target Antigen Cross-Binding(Human, Mouse, Monkey) | Binding activity detection | SPR/BLI | OK | |
| FcRn Binding | Binding activity detection | SPR/BLI | OK | |
| FcγR Receptor Family Binding | Binding activity detection | SPR/BLI | OK | |
| C1q Binding | Binding activity detection | ELISA | OK | |
| Functional Studies (in vitro) |
Cell screening | Protein expression detection | Flow cytometry, IHC | OK |
| Antibody binding | Antibody concentration titration | Flow cytometry | OK | |
| Cytotoxicity | Proliferation inhibition | CTG, Prestoblue, IncuCyte | OK | |
| Bystander effect | Flow cytometry, Incucyte | OK | ||
| Mechanistic research | Antibody endocytosis | Flow cytometry, Incucyte, Confocal | OK | |
| Apoptosis | Flow cytometry, Incucyte | OK | ||
| Cell Cycle | Flow cytometry | OK | ||
| ADCC, CDC, ADCP | Flow cytometry, LDH, CTG, Prestoblue | OK | ||
| Lysosome Co-localization | confocal | OK | ||
| Ligand Blocking | Flow cytometry | OK | ||
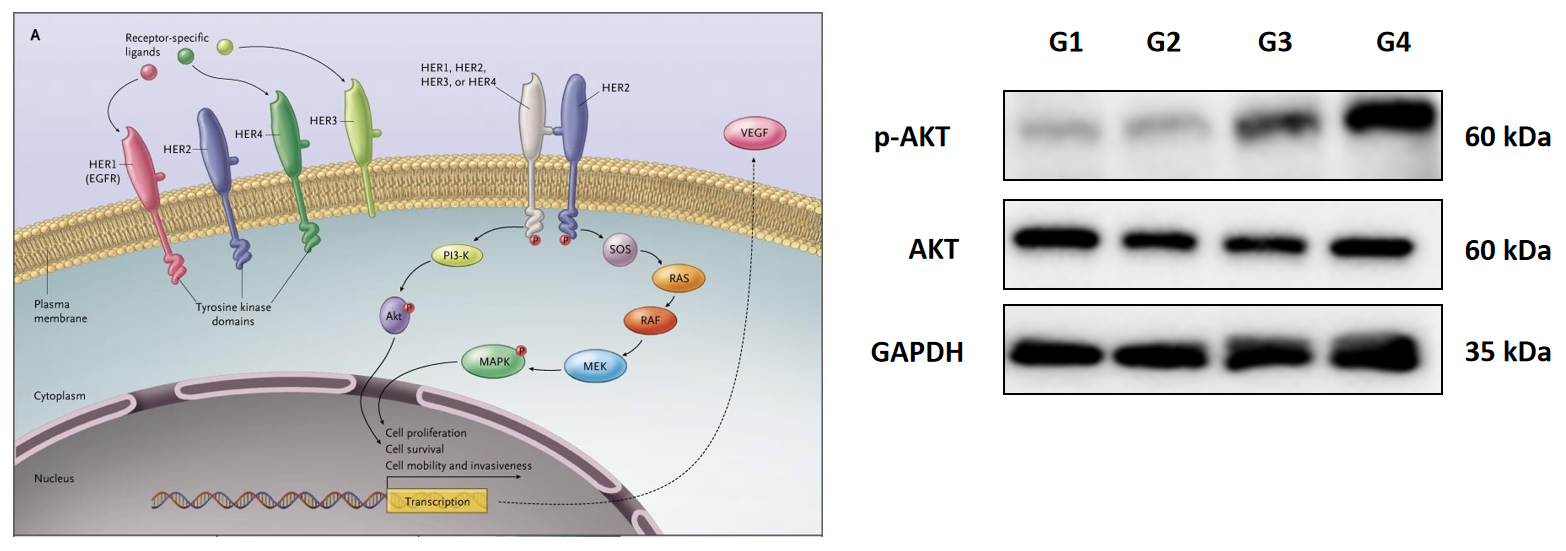
| Signaling pathways | Western Blot, MSD … | OK | ||
| Pharmacokinetics (ex vivo) |
Stability | Test stability of ADC in plasma (Human, Mouse, Monkey) | LC-MS | OK |
| PK Profile | Serum concentration monitoring | ELISA, MSD | OK | |
| Efficacy Studies (in vivo) |
Anti-tumor efficacy | CDX model | Tumor volume | OK |
| PDX model | Tumor volume | OK | ||
| Orthotopic model | Bioluminescence | OK | ||
| Bystander effect | Bioluminescence | OK | ||
| Tissue distribution | ELISA, MSD | Developing |
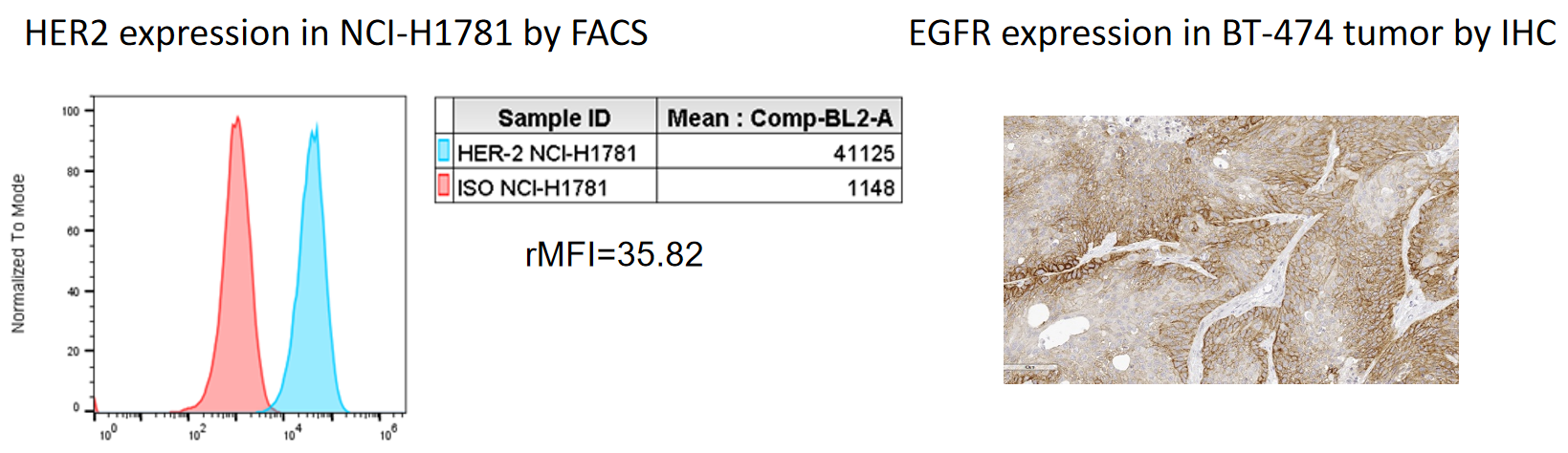
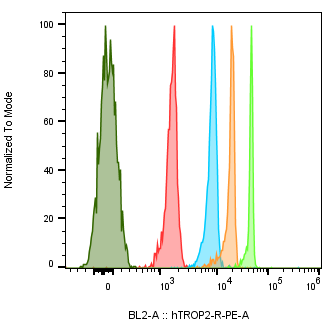
肿瘤细胞系中Trop2的绝对定量表达
| Cell Line Name | Trop2 Expression level (/cell) |
| NCI-N87 | 667,835 |
| A431 | 3,816,803 |
| MCF-7 | 445,552 |
| NCI-H292 | 1,375,075 |
| NCI-H520 | 822 |
| NCI-H1975 | 401,381 |
| HCC827 | 821,464 |
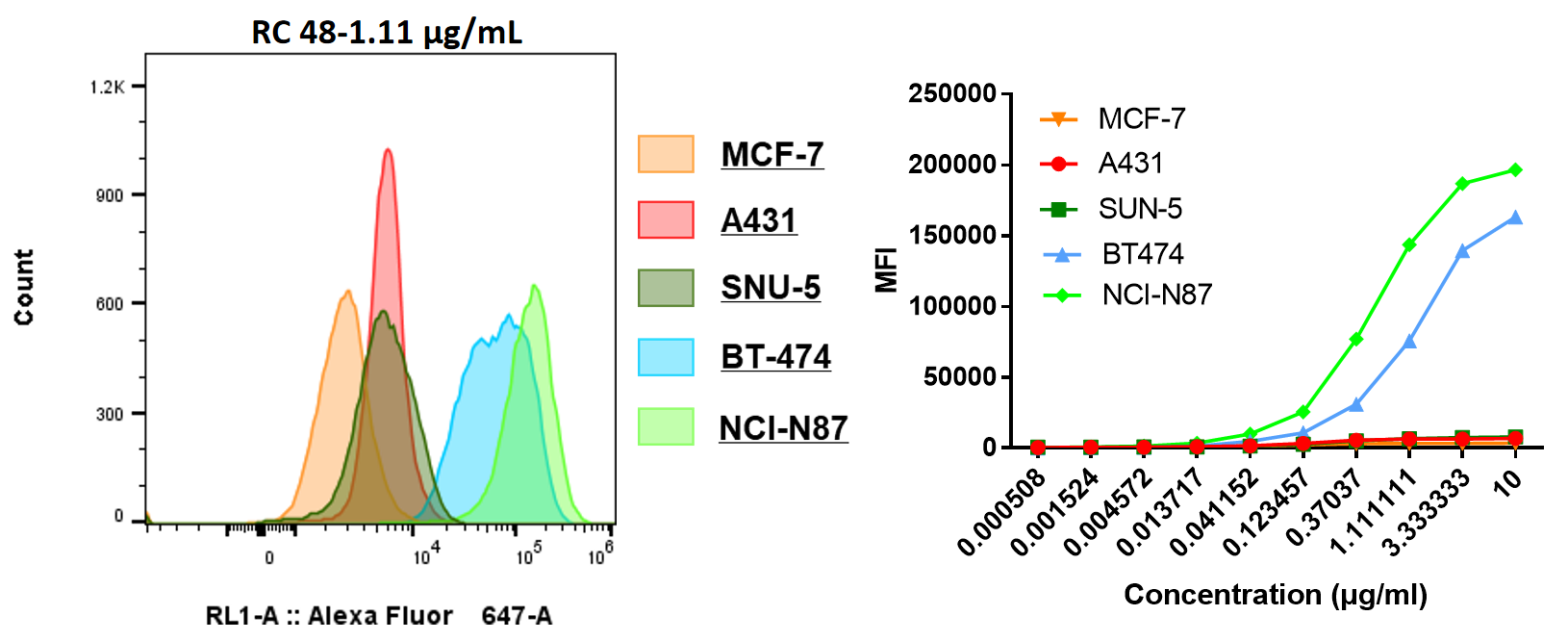
| EC50 (μg/mL) | |
| NCI-N87 | 0.511 |
| MCF-7 | - |
| BT474 | 1.042 |
| SNU-5 | - |
| A431 | - |
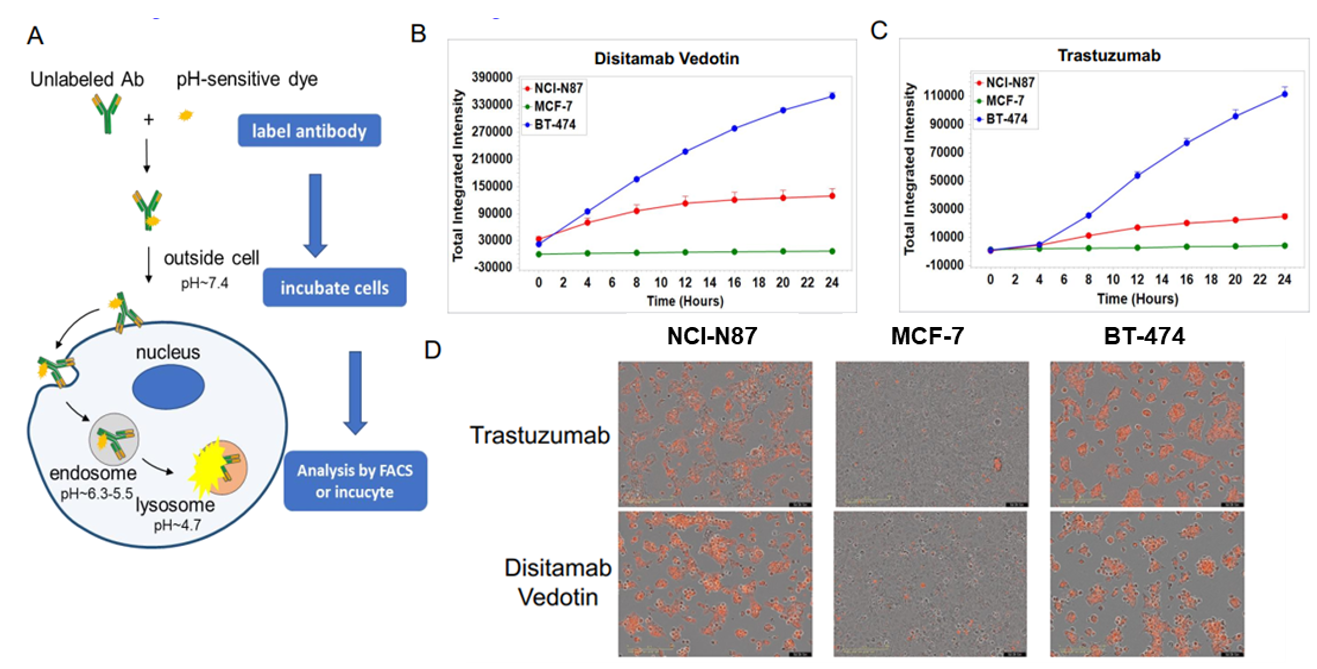
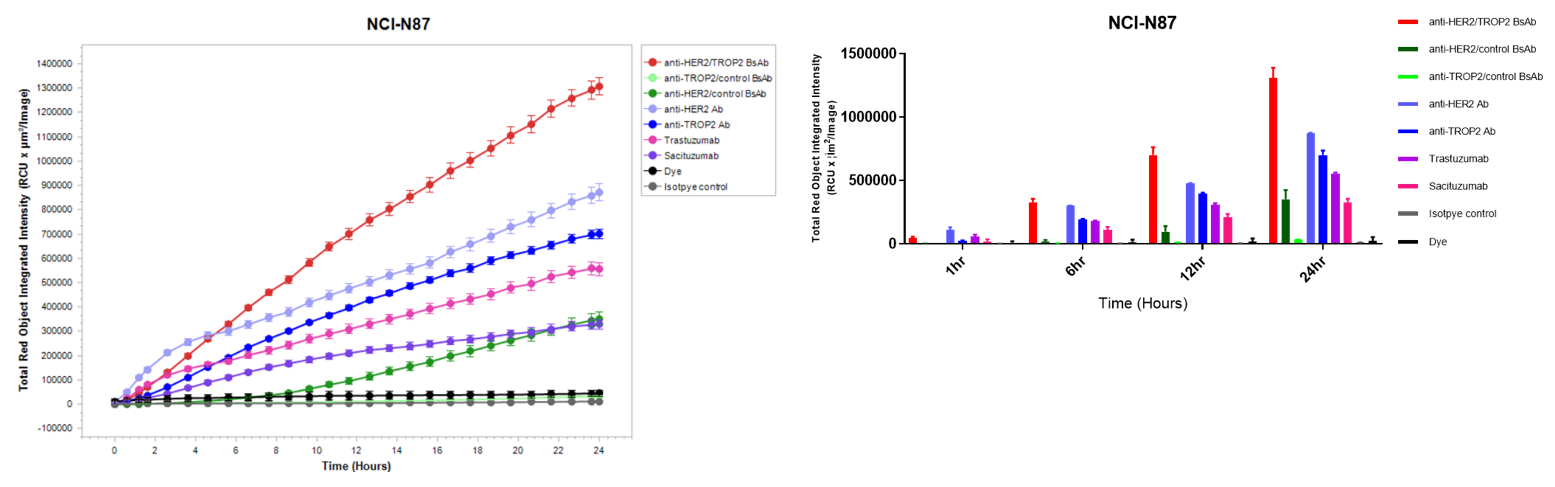
体外内吞实验:Disitamab Vedotin(RC-48)和trastuzumab。 A:抗体内吞检测示意图。将NCI-N87、MCF-7和BT-474细胞与pH敏感染料标记的Disitamab Vedotin(RC-48)或Trastuzumab孵育24小时,并用IncuCyte连续观察。 B-C:纵坐标表示细胞内抗体的信号强度;D:Disitamab Vedotin(RC-48)和Trastuzumab都以时间依赖的方式被内吞到NCI-N87和BT-474细胞中,而在MCF-7细胞中未观察到。
| gene_name | FPKM NCI_N87 |
| HER2 | 1444 |
| TROP2 | 761 |
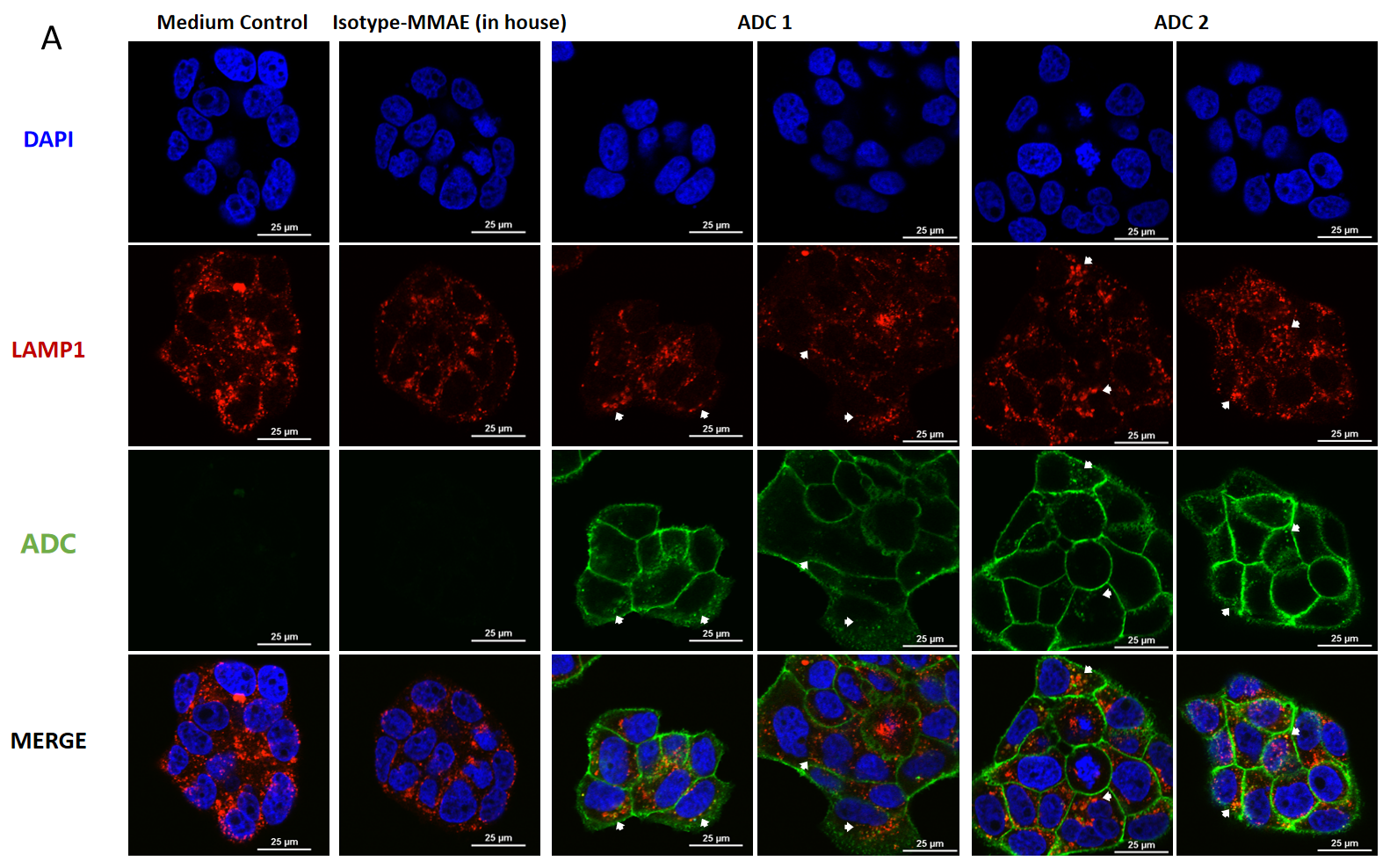
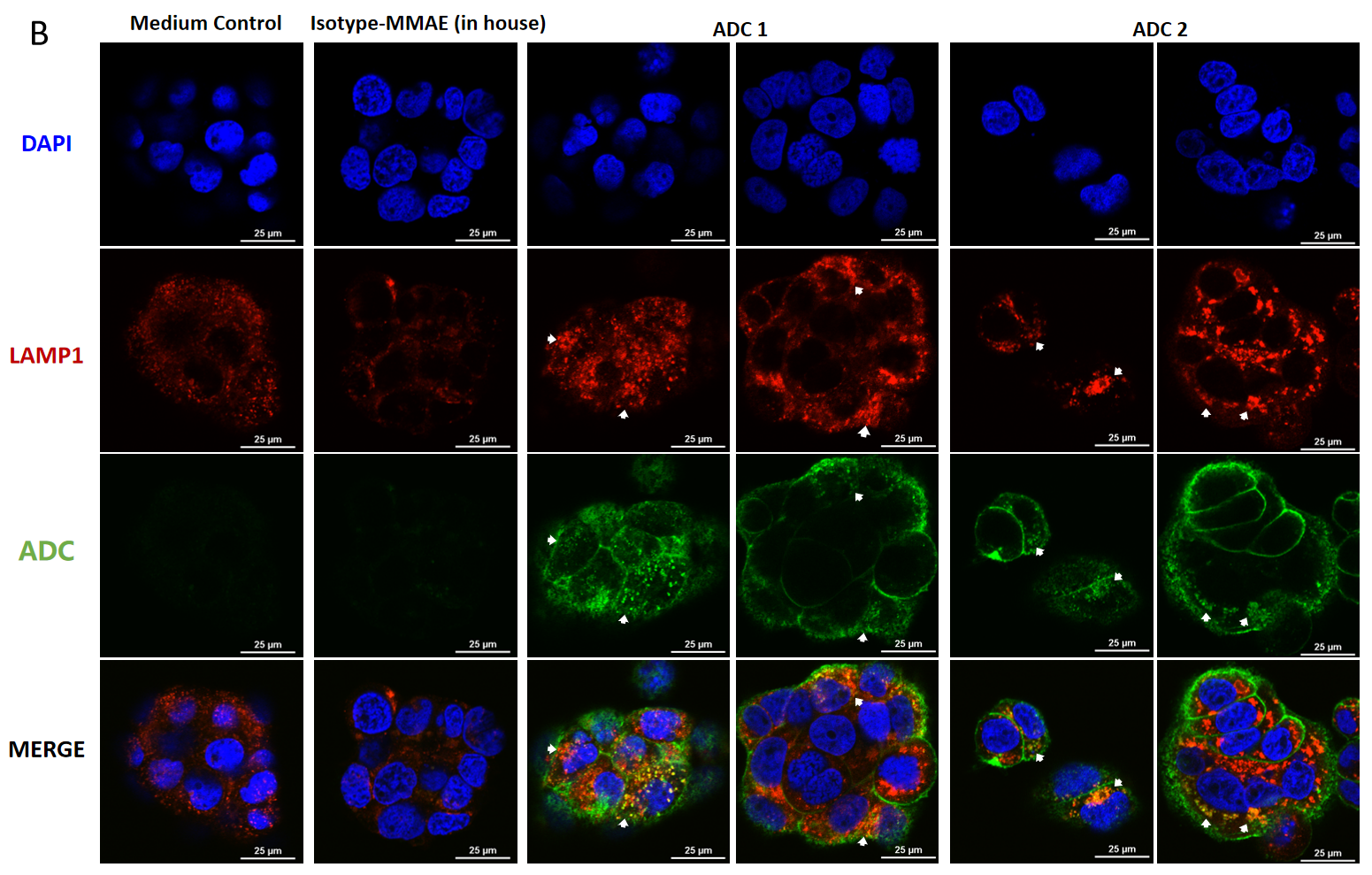
BT474(Her2+和Trop2+)细胞的共聚焦显微镜图像,显示MMAE偶联ADC的内吞和溶酶体转运。
BT474细胞分别在(A) 处理4小时和(B) 处理24小时后(每种ADC浓度为10 μg/mL),进行染色观察。使用FITC标记的山羊抗人IgG抗体(绿色)标记ADC,溶酶体使用LAMP1小鼠单克隆抗体及Cy3标记的山羊抗小鼠IgG二抗染色(红色),细胞核使用DAPI染色(蓝色)。比例尺为25 μm。
| MDA-MB-468: BT474 | ||
| 0:1 | 1:0 | 1:1 |
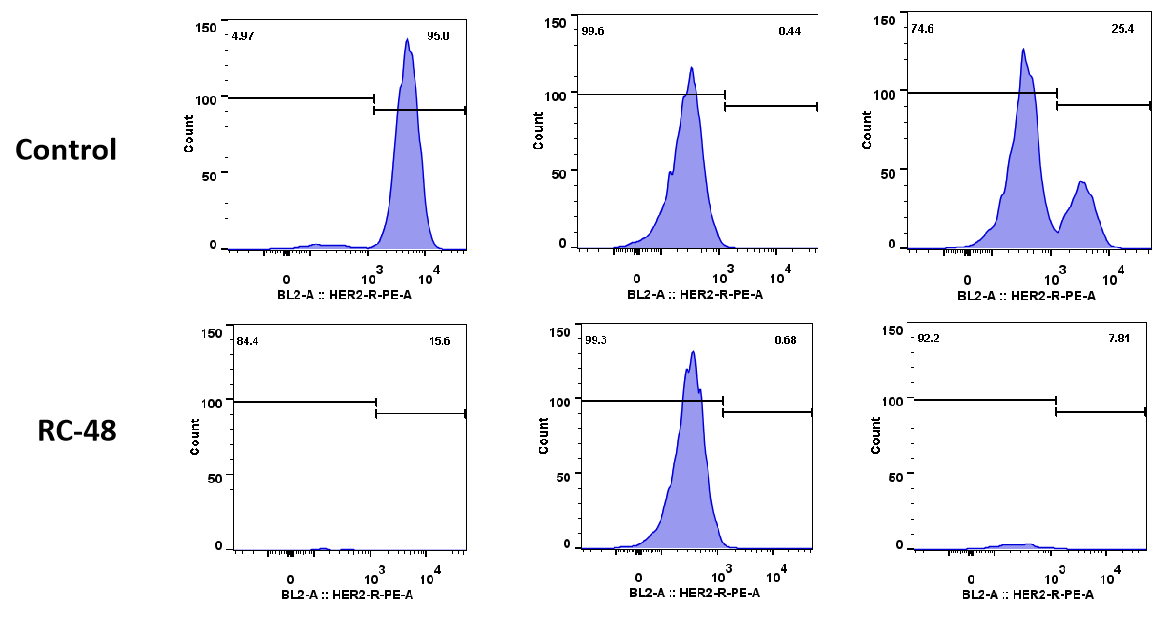
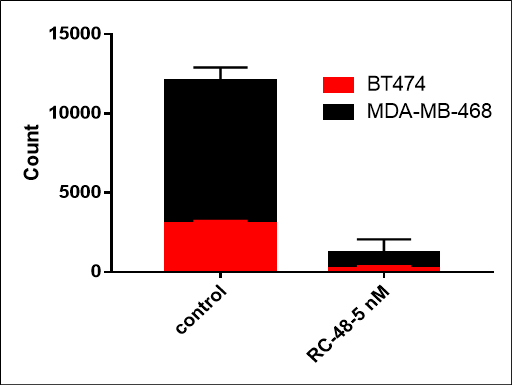
将MDA-MB-468细胞(HER2阴性)和BT-474(HER2阳性)以不同比例(分别为0:1、1:0、1:1)共培养过夜。用Disitamab vedotin (RC-48)或Vehicle处理5天后,通过流式细胞仪检测细胞数量和HER2阳性及HER2阴性细胞的比例。RC48对BT474细胞表现出显著的肿瘤杀伤作用,而对MDA-MB-468细胞几乎没有细胞毒性。重要的是,RC48也能在与BT474细胞共同培养时杀伤MDA-MB-468细胞。
| B-CAG-luc-GFP KI, EGFR KO BxPC-3: BxPC-3 | ||
| 1:1 | 1:0 | 0:1 |
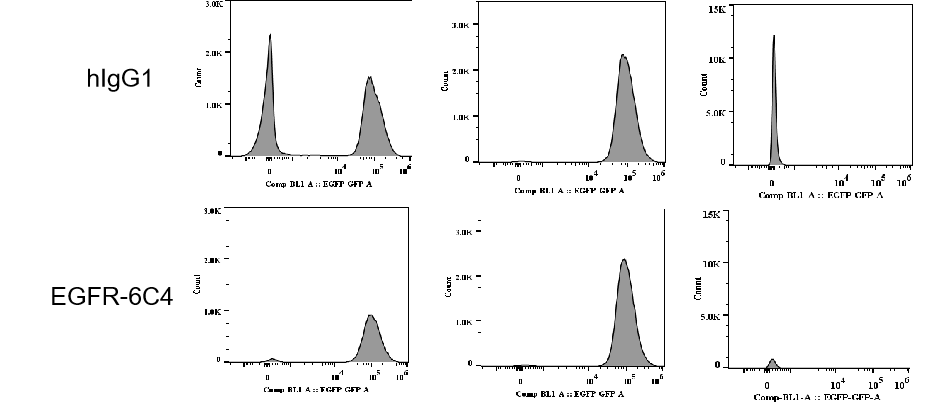
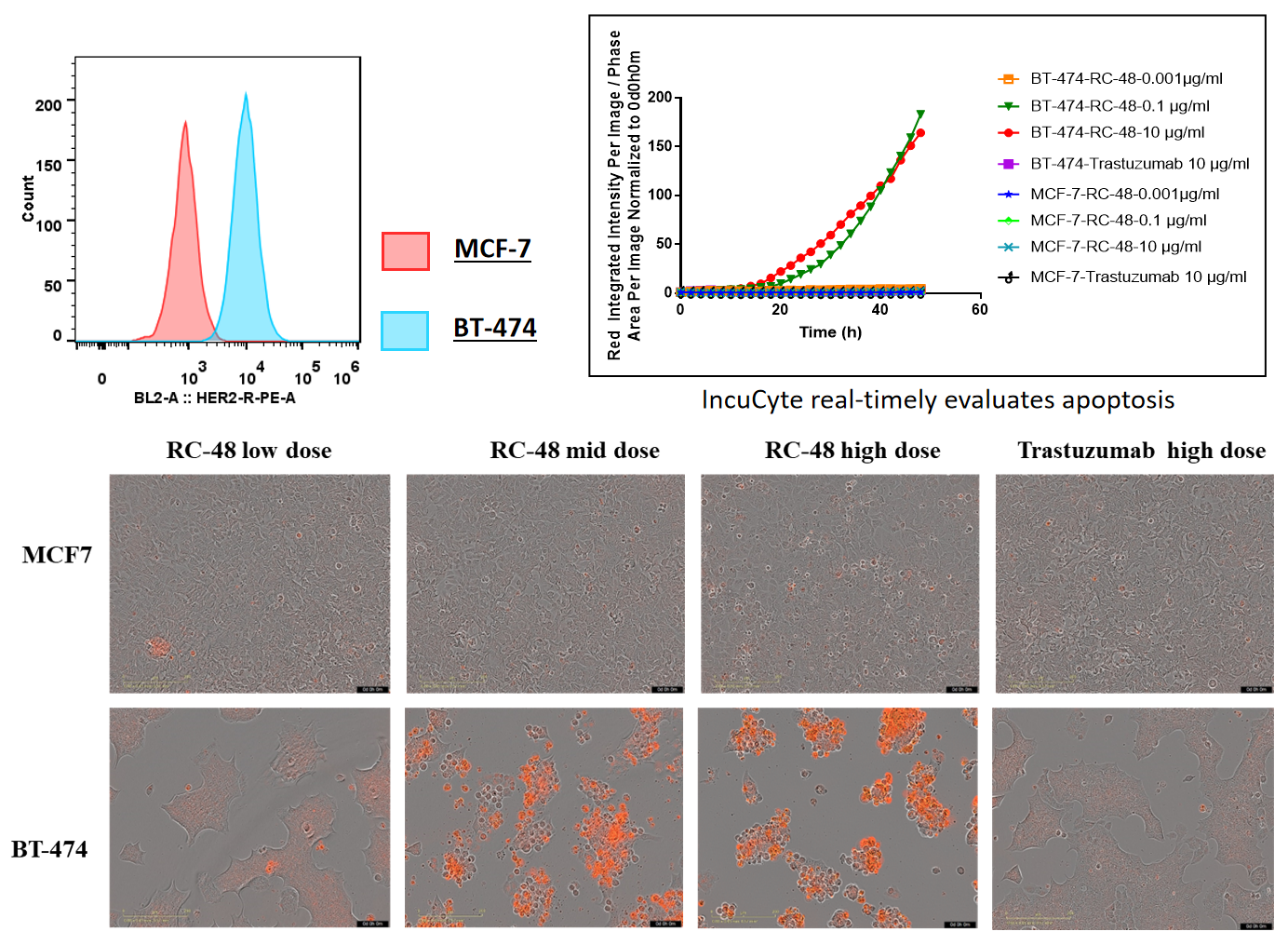
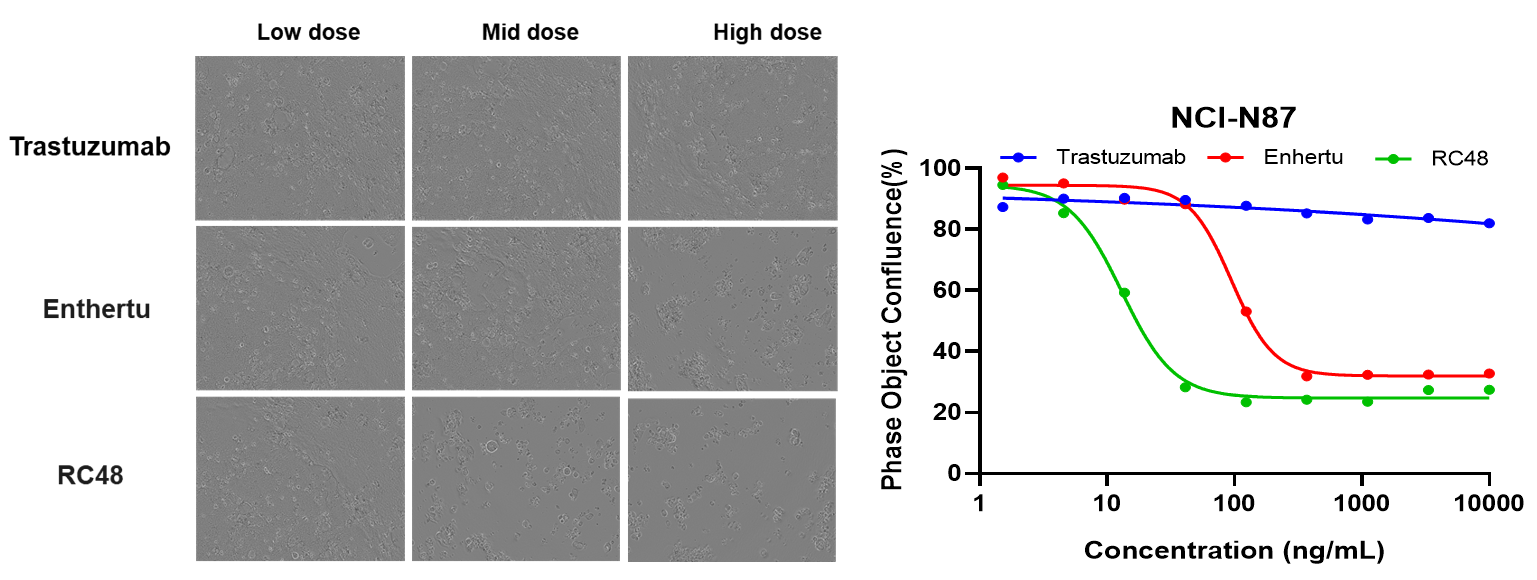
BT-474(Her2+)和MCF7(Her2-)细胞在不同浓度的trastuzumab或RC48处理72小时后。通过Sartorius IncuCyte Caspase-3/7红色凋亡试剂检测凋亡。红色信号表示激活的caspase 3/7。RC48(中高剂量)显著促进了BT-474的凋亡,而trastuzumab则没有。同样,MCF7细胞在处理后未观察到凋亡。
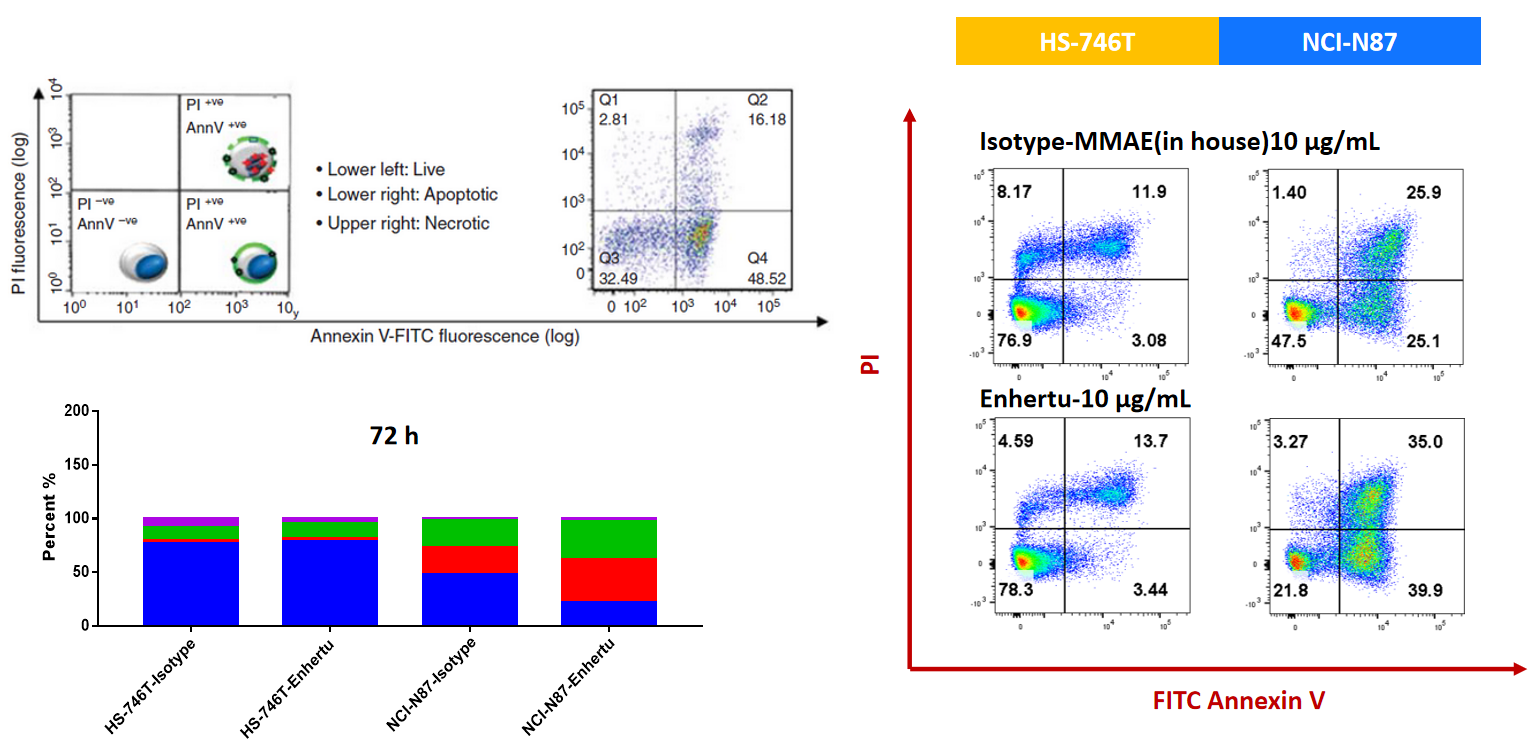
NCI-N87(Her2+)和HS-746T(Her2-)细胞在ISO-MMAE和Enthertu处理72小时后。通过Annexin V/PI试剂盒和流式细胞术检测凋亡。对于Her2高表达的NCI-N87,Enthertu可显著诱导凋亡。
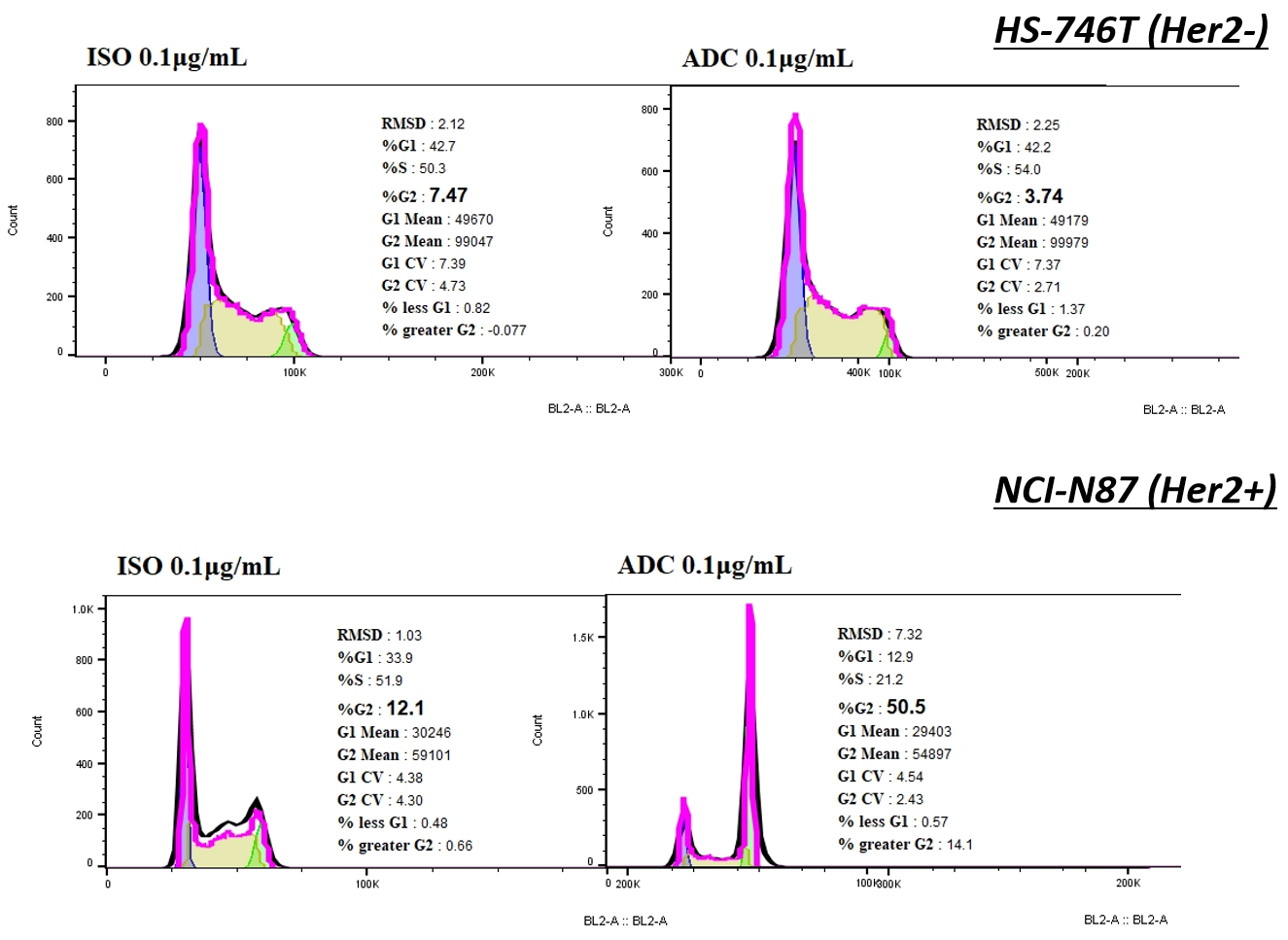
与ISO-MMAE相比,Her2-MMAE能引发NCI-N87细胞周期停滞,并伴随着G2/M期细胞比例的急剧增加,而在HS-746T细胞中未观察到。
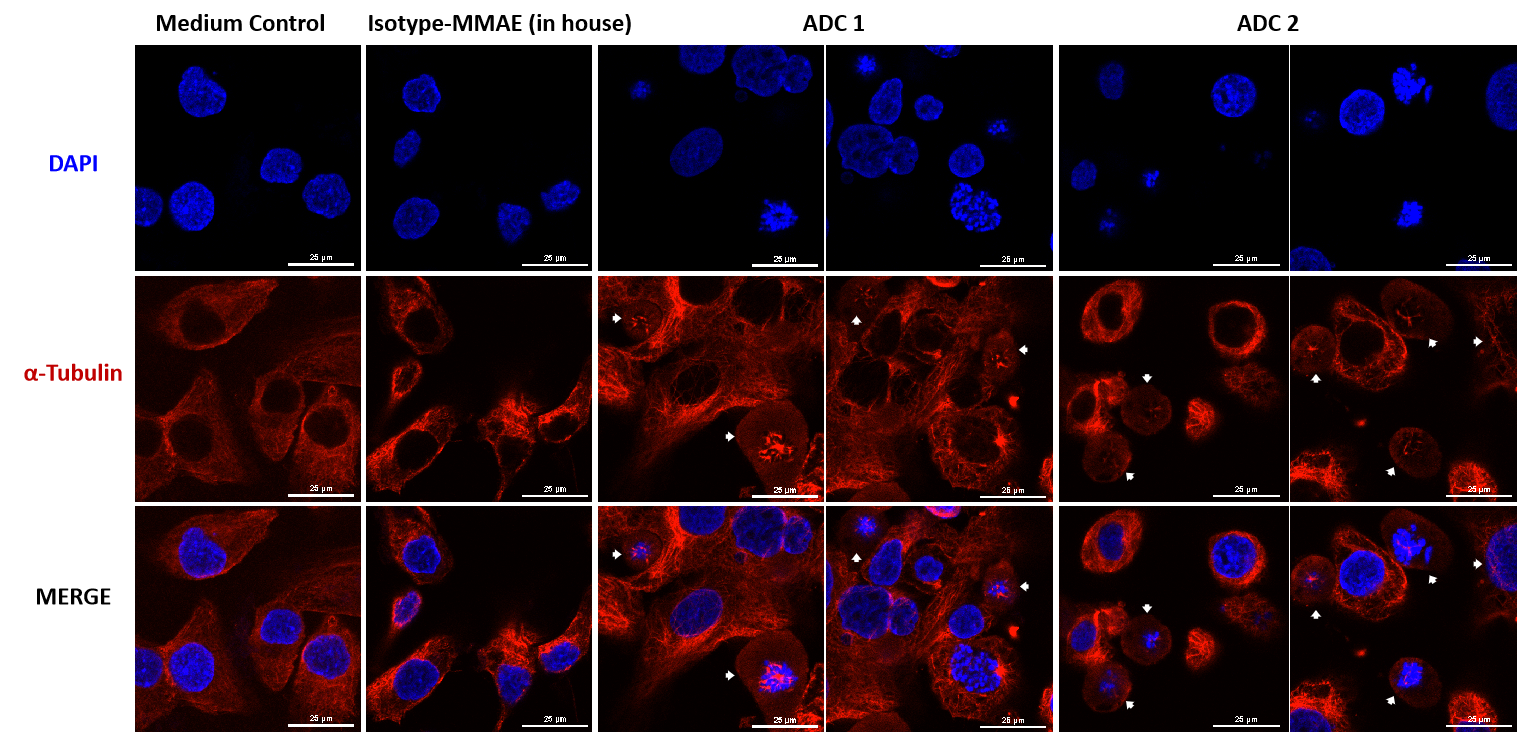
MMAE偶联ADC通过共聚焦显微镜观察可破坏细胞内微管网络。
SKOV-3细胞(Her2+和Trop2+)在MMAE偶联ADC处理24小时(每种ADC浓度为10 μg/mL)后,微管用PE标记的α-Tubulin小鼠单克隆抗体(红色)染色,细胞核用DAPI(蓝色)染色。比例尺:25μm。
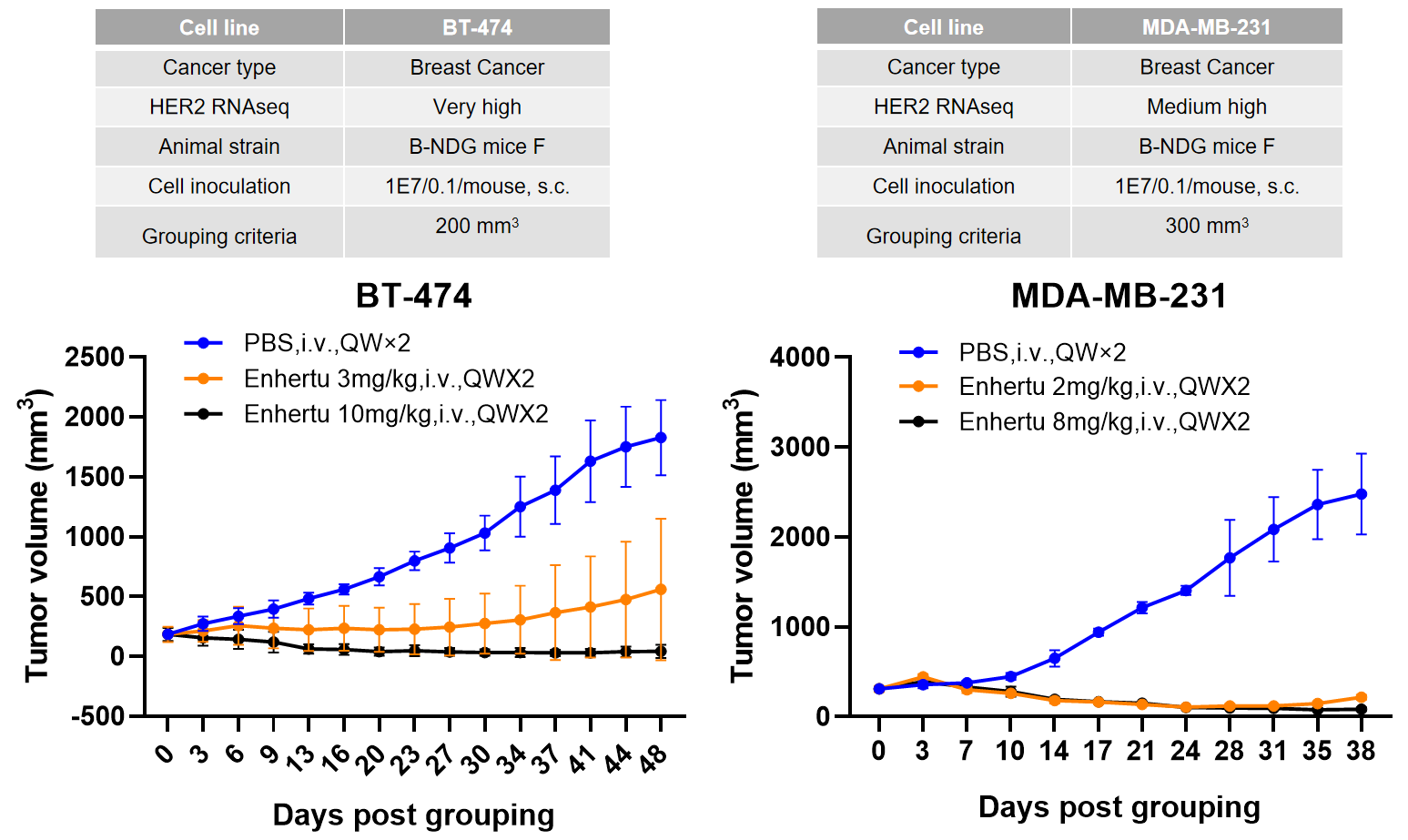
胰腺癌细胞系B-luc MIA Paca-2原位接种,Her2-ADC治疗后显著抑制肿瘤生长。
点击此处查看我们的原位CDX模型列表
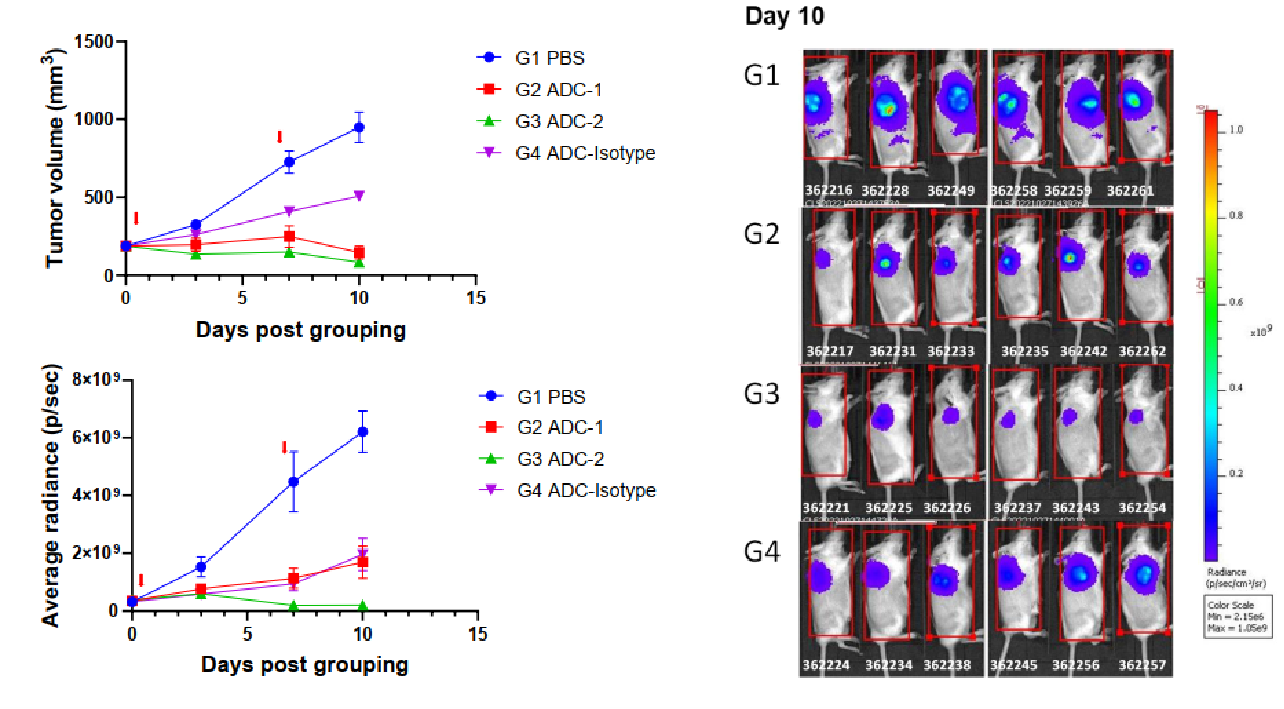
在共接种条件下的体内旁观者杀伤效应研究。将NCI-H1975(靶点阳性)和B-luc Daudi(靶点阴性)细胞混合接种7天后,小鼠于第0天和第7天经静脉注射ADC药物。通过体内成像仪检测荧光素酶活性。 (左上)估算肿瘤体积;(左下)荧光素酶活性;(右)第10天的荧光素酶活性成像数据(n=6)。如图所示,ADC2可显著抑制B-luc Daudi(靶点阴性)细胞的生长,提示其具有明显的旁观者杀伤效应;而ADC1则未表现出类似作用。
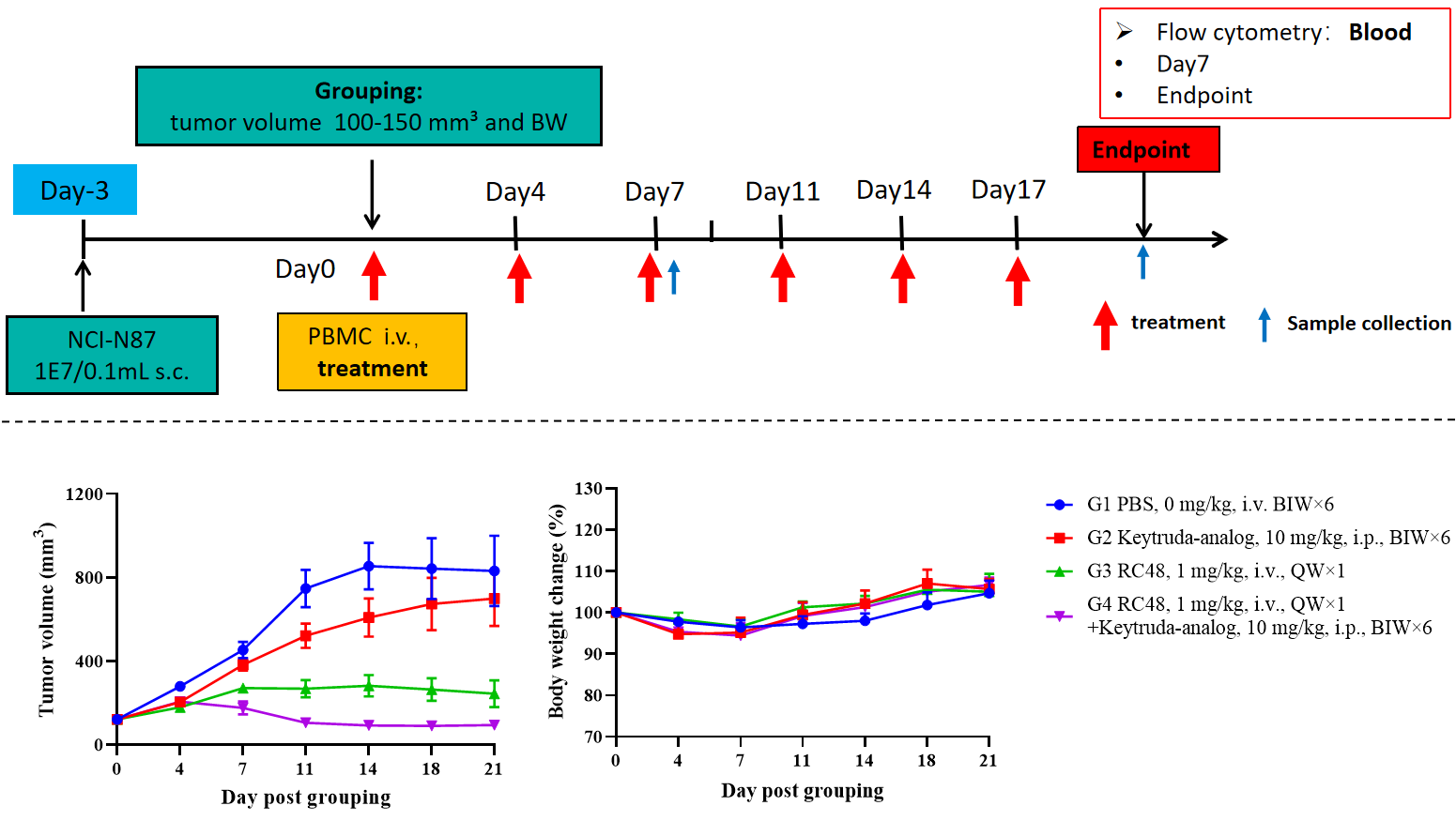
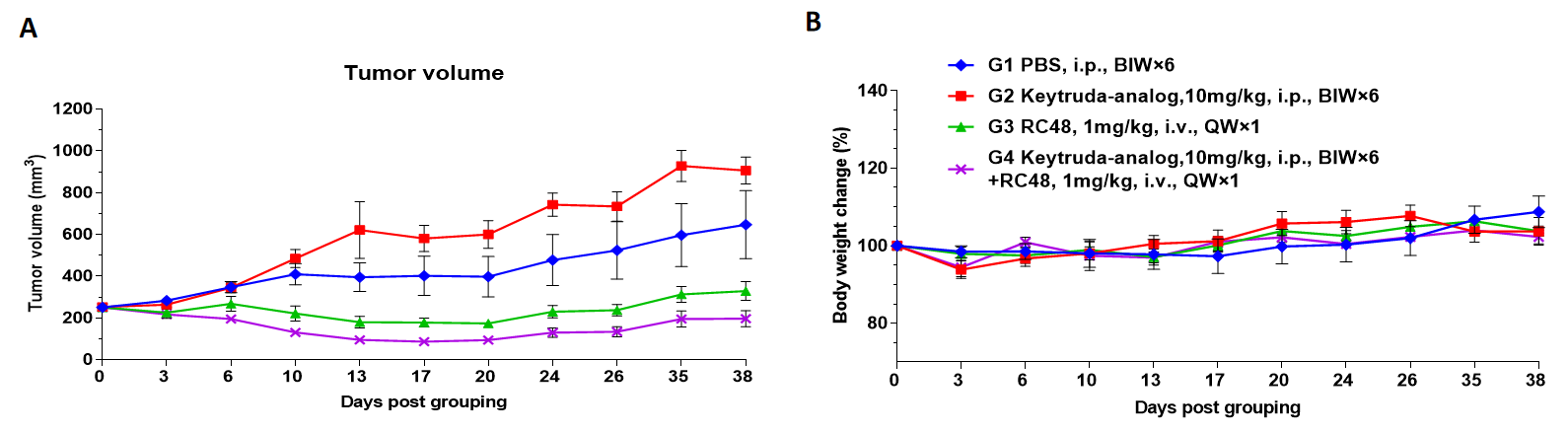
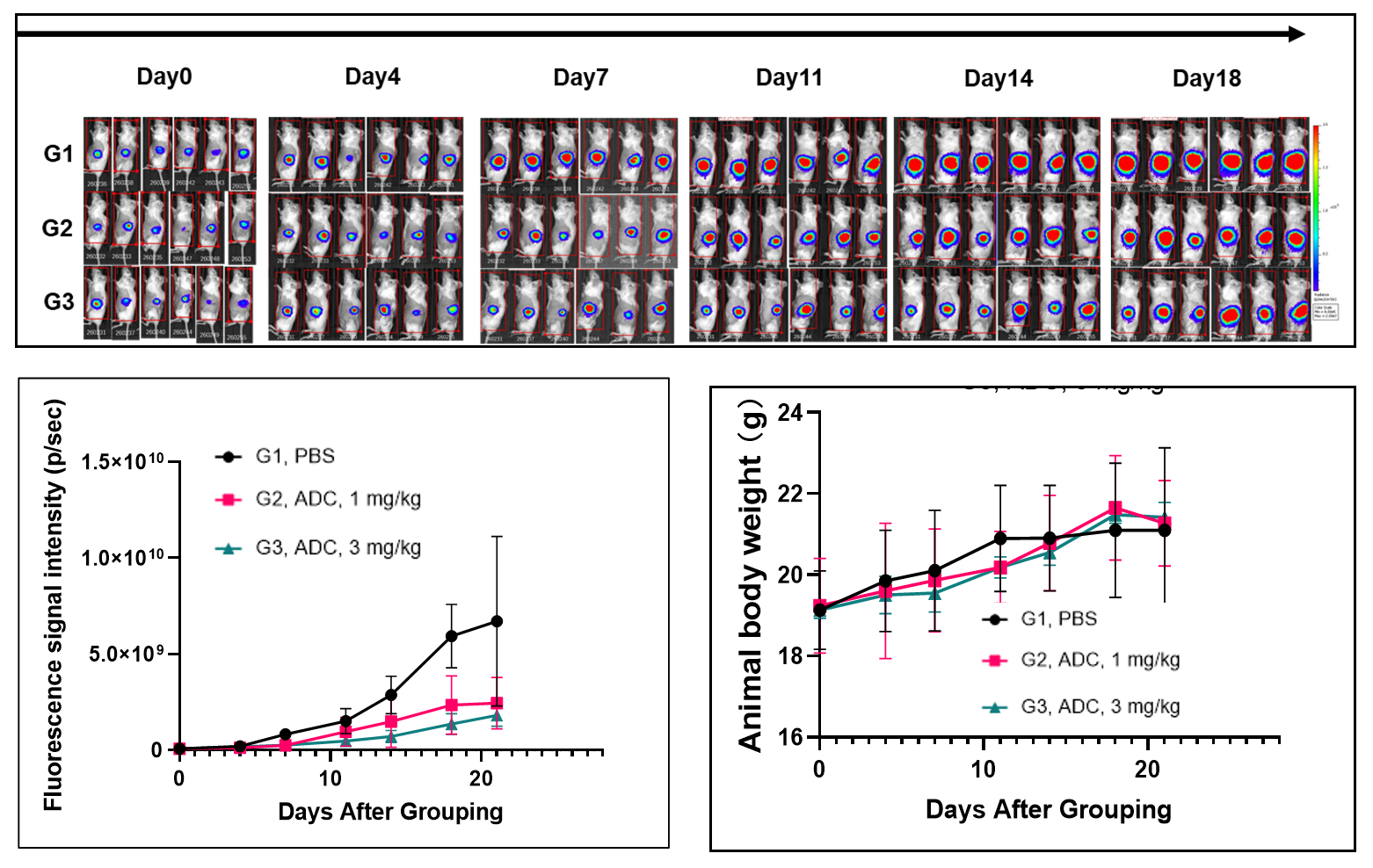
CD34+细胞重建B-NDG hIL15小鼠用于药物药效研究。
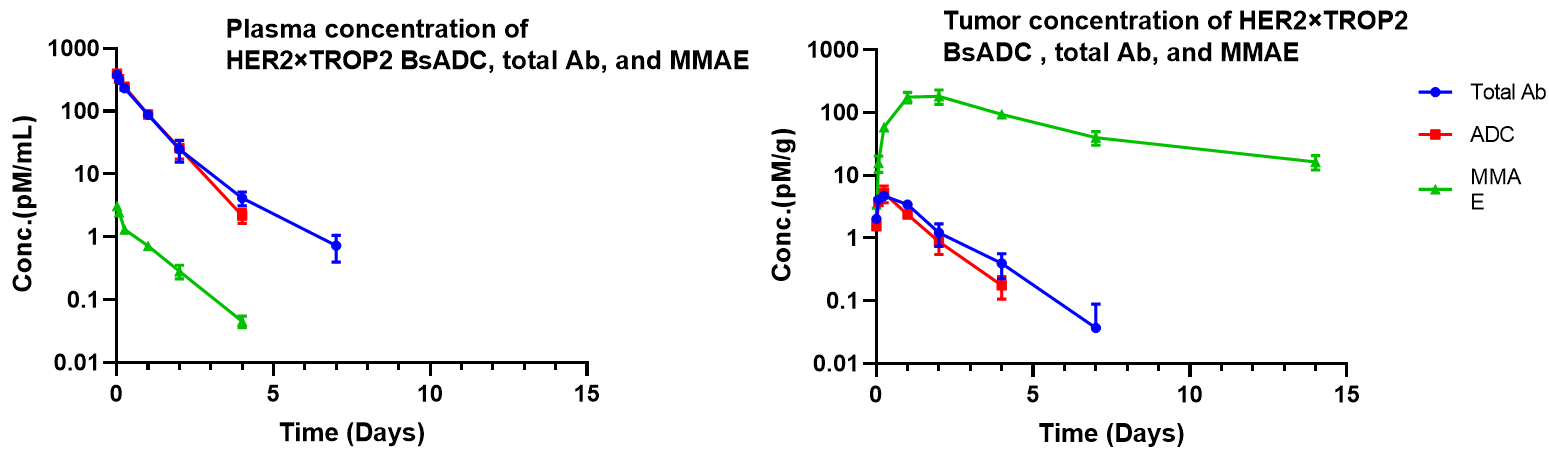
HER2×TROP2 BsADC在NCI-H1975异种移植模型中的药代动力学分析。在单次给药3 mg/kg剂量的HER2×TROP2 BsADC后,载药MMAE在肿瘤中积累,但在血浆中呈降低水平。该结果表明HER2×TROP2 BsADC实现了有效的肿瘤靶向递送MMAE,具有潜在更优的抗肿瘤活性。