在此页面上
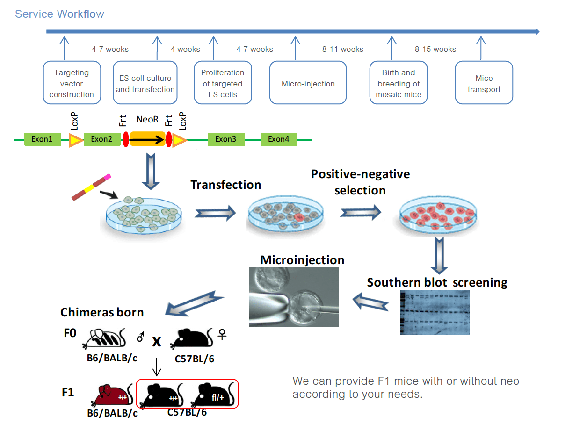
基于胚胎干细胞的基因编辑是利用干细胞的全能性进行基因编辑小鼠制备。首先将打靶载体电转进小鼠胚胎干细胞。筛选成功重组的细胞克隆,注射到正常小鼠囊胚中。注射后,干细胞在囊胚中扩增分化,形成嵌合胚胎。然后将囊胚移植到代孕小鼠中。最终,将嵌合小鼠与野生小鼠品系进行繁育,获得含有可遗传目的基因的模式动物。
尽管传统的基因编辑方法也能够完成基因编辑,但基于ESC/HR的基因编辑提供了以下优势:

在基于ESC技术的基因敲除小鼠中,我们使用正筛选标记来替换目的基因的外显子,目的基因被全身性敲除,而在条件性敲除动物中,该基因仅在选定的细胞中被敲除,这由组织特异性启动子决定。通常使用Cre-LoxP或Flp-Frt重组酶系统制备条件基因敲除小鼠模型。
将目的DNA片段插入基因组中的特定位置来制备基因敲入小鼠。利用这种方式也可以制备包括点突变,报告基因敲入,标签敲入,Cre工具鼠和人源化小鼠等。
基于ES细胞的靶向技术能够实现复杂基因组的修饰,并支持在小鼠基因组中实现大于6kb的片段敲入。
百奥赛图的ES细胞维持了100%纯合的C57BL/6遗传背景,可节省高达2年的回交时间成本。
项目启动后,我们将为您配备专属项目经理,定期(每月)提交模型构建进展报告,并支持您随时与项目经理直接沟通项目细节。
在靶向载体构建过程中,正筛选标记(NEO抗性基因)和DTA负筛选标记被引入;同时,在靶向载体的特定位点添加限制酶切位点。将载体电穿孔到ES细胞中后,使用G418选择进行阳性克隆。我们还通过Southern blot排除随机插入。同时运用染色体带型分析技术监测长期体外培养的ES细胞核型稳定性——依据染色体长度、着丝粒位置及臂率进行核型配对与编号分析,确保仅对核型完整的优质ES细胞实施后续显微注射
基因靶向中最重要的因素是小鼠胚胎干细胞的品系;某些品系的ES细胞比其他品系更容易进行靶向。文献中报告的同源重组成功率为0.5%-3%,但在一些特定的位点,如Rosa26位点,靶向效率明显较高。如果使用C57BL/6胚胎干细胞进行重组,基因靶向效率相对较高。