

您可能也喜欢
肺癌是最常见的肺部原发性恶性肿瘤,死亡率居所有癌种首位,已成为我国第一大癌症。非小细胞肺癌(NSCLC)为肺癌的常见分型,约占所有肺癌病例的80%-85%[1],目前发现其发生发展机制与某些驱动基因突变相关,EGFR突变是NSCLC最常见的驱动基因之一,特别是在亚洲人群中,此类突变的发生率较高。
2024年8月强生宣布其EGFR/MET双抗amivantamab-vmjw(埃万妥单抗)与第三代EGFR抑制剂lazertinib(拉泽替尼)联用方案经美国FDA批准上市。用于一线治疗晚期EGFR突变的非小细胞肺癌患者,是目前唯一一个与奥希替尼相比,显示出更优的无进展生存期(PFS)的无化疗方案。
EGFR 是表皮生长因子受体家族成员之一,是一种跨膜糖蛋白, 具有配体诱导酪氨酸蛋白激酶活性, 广泛分布于除血管组织外的上皮细胞膜上。EGFR 与肿瘤细胞增殖、 血管生成、 肿瘤侵袭、 转移及细胞凋亡抑制有关。 研究表明, EGFR 在多种实体瘤中高表达或异常表达, 如胶质细胞瘤、 肺癌、 前列腺癌、 胰腺癌等肿瘤组织中都有 EGFR 过度表达。目前已有多种EGFR靶向治疗药物获批上市,包括单抗、小分子及双抗等药物。
EGFR单抗药物
靶向细胞表面的特异性抗原EGFR的单克隆抗体,可以通过多种机制抑制肿瘤生长,其主要抗肿瘤机制如下:
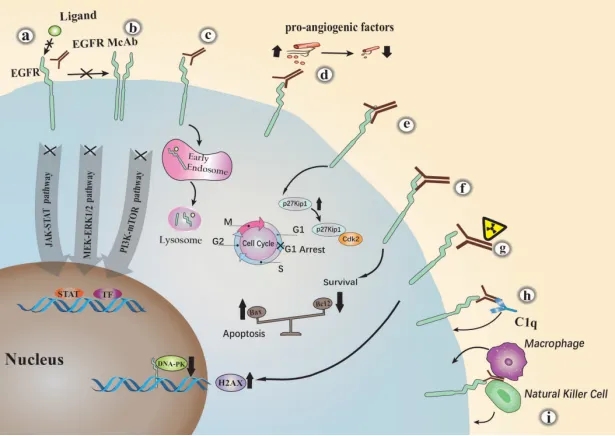
EGFR抗体主要抗肿瘤机制[2]
EGFR-TKI药物
针对EGFR突变的酪氨酸激酶抑制剂(TKIs)已经成为EGFR突变肺癌患者的一线治疗选择,EGFR-TKI药物近年来一直在更新换代,目前上市的药物已经发展到第三代。然而,尽管初始治疗反应良好,但几乎所有接受EGFR TKI治疗的患者最终都会不可避免的发展出获得性耐药,导致疾病进展生存受限。
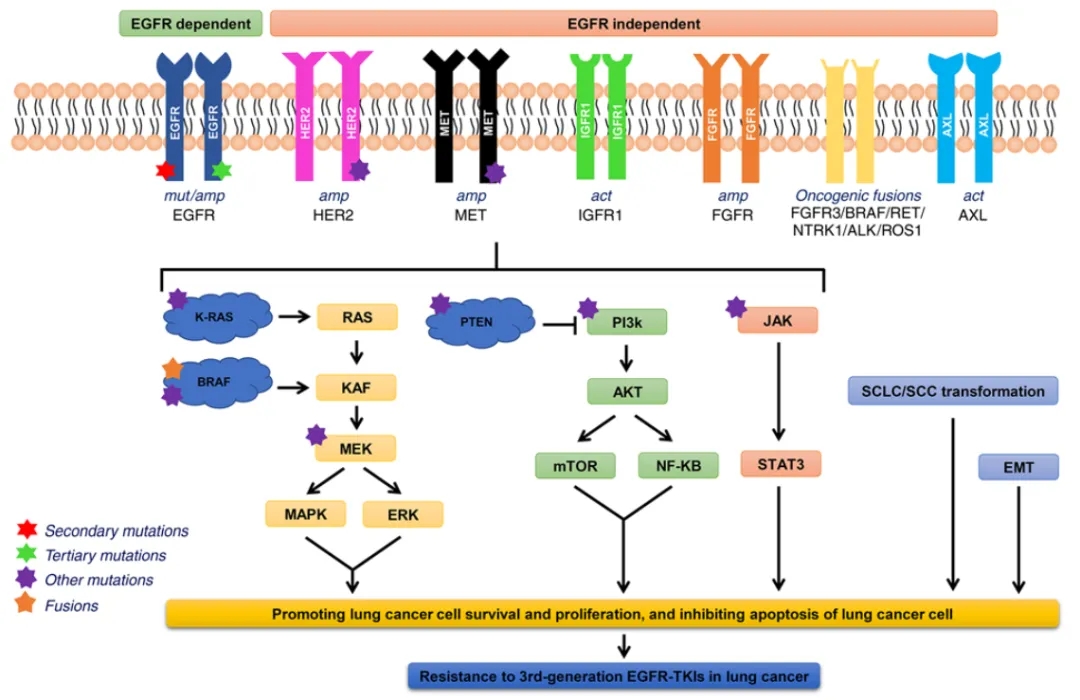
三代EGFR-TKI的获得性耐药机制[3]
进一步研究发现,合并原发间质-上皮细胞转化因子(MET)异常是导致EGFR突变患者对EGFR-TKI治疗无反应或反应时间较短的重要原因[4]。MET(或c-MET)基因扩增一直被认为是第一代或第三代EGFR-TKls的重要耐药机制。联合靶向治疗是耐药患者的一种很有前景的策略,多种新型联合治疗的临床研究正在进行中。
MET信号通路
MET(c-MET,cellular-mesenchymal epithelial transition factor))是细胞间质上皮转换因子,受体酪氨酸激酶家族成员,是调节上皮癌起始、进展和恶性肿瘤的致瘤性决定因素。MET信号通路激活可介导的细胞生长、存活、侵袭性、化疗耐药和致瘤性等。MET 在一般组织中呈低表达或不表达,但在多种类型的实体瘤中如肺癌、胃癌、肝癌、乳腺癌、皮肤癌、大肠癌等存在异常表达或突变,在肿瘤的发生发展中发挥了重要的作用。
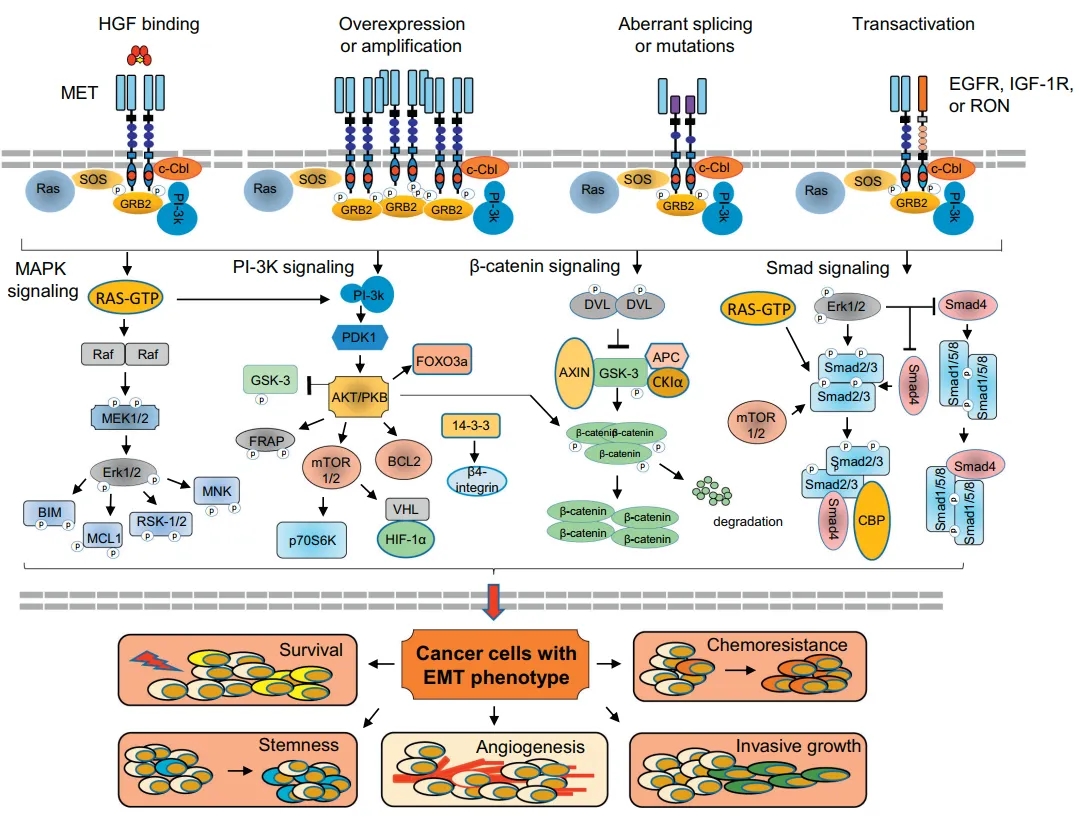
MET的激活机制、信号通路和生物学后果[5]
研究表明,MET被激活后,诱导细胞内酪氨酸残基的同二聚化和磷酸化,从而激活下游RAS/ERK/MAPK和PI3K-AKT信号通路。这些通路可以驱动细胞存活、增殖、运动、迁移、侵袭、血管生成和上皮-间质转化(EMT),在EGFR抑制剂存在下提供了一条旁路通路,导致耐药性增加[6,7]。
靶向EGFR/MET双特异性抗体
靶向双肿瘤相关抗原的双特异性抗体(BsAb)具有调用两种信号通路之间的协同效应、增加靶组织特异性和降低全身毒性的优势。通过结合抗体介导的特异性靶向和细胞毒性有效载荷的有效杀伤,抗体-药物偶联物(ADC),特别是双特异性ADC (BsADC),已成为强大的治疗策略。
EGFR和MET是在多种肿瘤中共同表达的致癌蛋白。此外,MET扩增与非小细胞肺癌(NSCLC)患者EGFR酪氨酸激酶抑制剂的耐药有关。这些结果表明EGFR/MET双特异性抗体可以成为EGFR和MET共表达肿瘤的有效治疗选择,并克服MET驱动的EGFR-TKI耐药,从而改善患者预后。
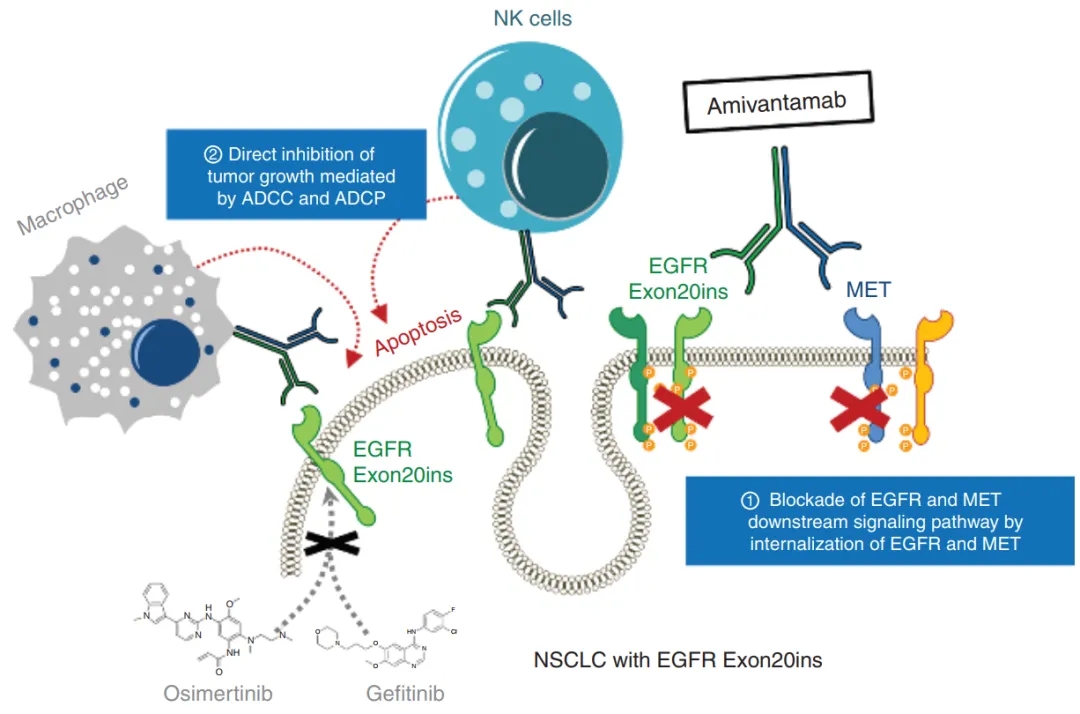
EGFR/MET双特异性抗体抗肿瘤机制[8]
百奥动物开发了B-hEGFR/hMET、B-hEGFR、B-Tg(hEGFR) MC38等一系列人源化小鼠及细胞系,是EGFR及MET靶点单抗、双抗、联合治疗药物的体内药效及安全性评价的有力工具,期望助力全球药企研发进展。
部分数据展示
B-hEGFR/hMET小鼠
mRNA表达分析
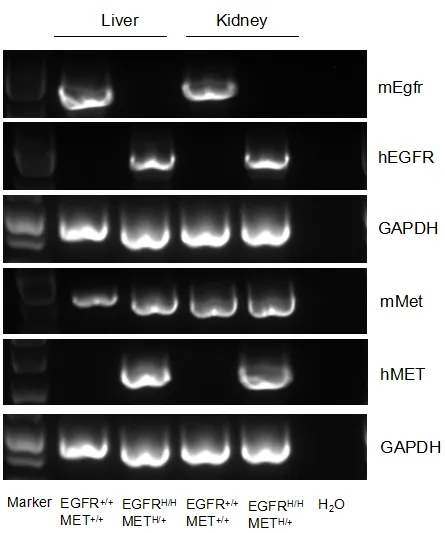
小鼠Egfr mRNA仅在野生型小鼠的肝脏和肾脏中检测到,小鼠Met mRNA在野生型小鼠和B-hEGFR/hMET小鼠的肝脏和肾脏中检测到。人EGFR mRNA及人MET mRNA仅在B-hEGFR/hMET小鼠中检测到,而在野生型小鼠中检测不到。
蛋白表达分析
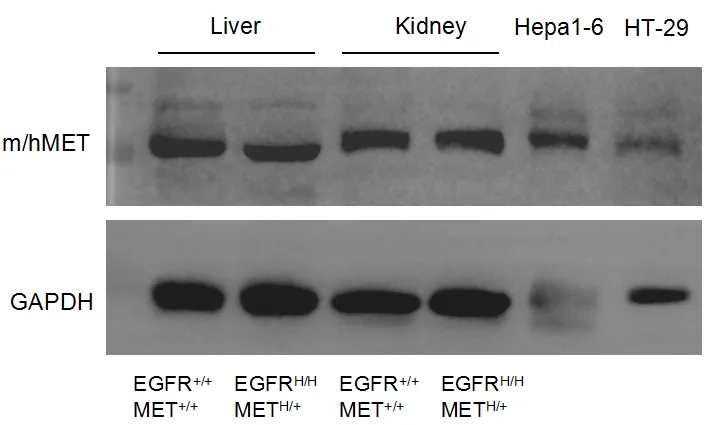
取野生型小鼠和B-hEGFR/hMET小鼠的肝脏和肾脏,用抗MET抗体进行western blot分析。由于抗体的交叉反应性,野生型小鼠和B-hEGFR/hMET小鼠均可检测到MET。
EGFR表达的IHC分析
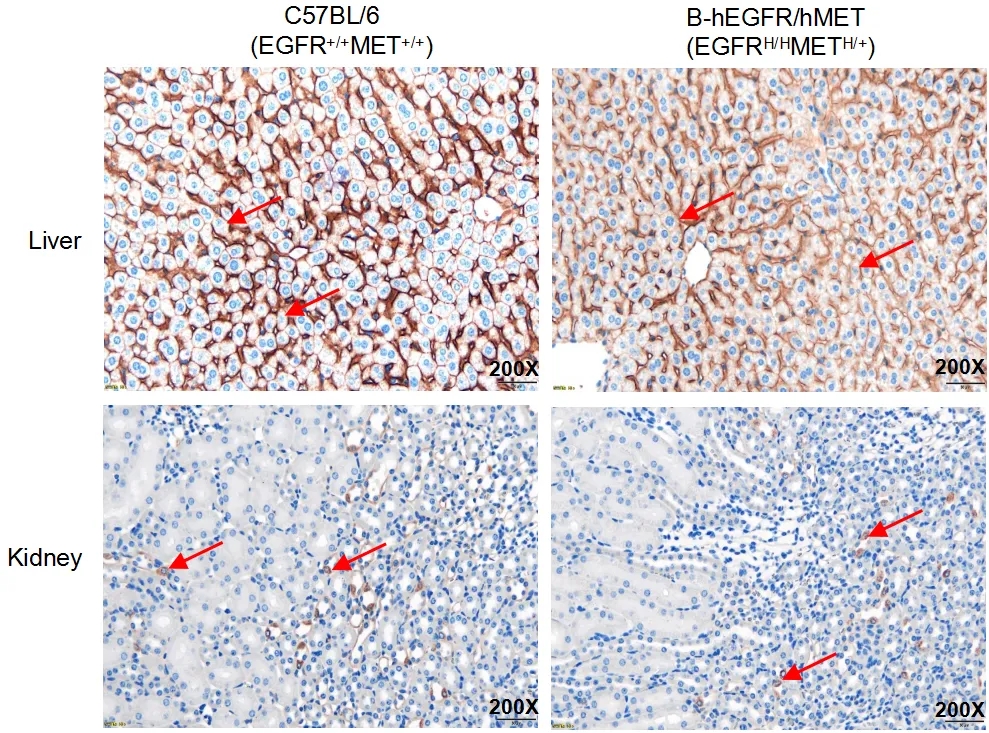
在野生鼠的肝脏和肾脏中检测到小鼠EGFR蛋白表达,在B-hEGFR/hMET小鼠中检测到人EGFR蛋白表达。
B-hEGFR小鼠及B-Tg(hEGFR) MC38细胞
EGFR表达的IHC分析
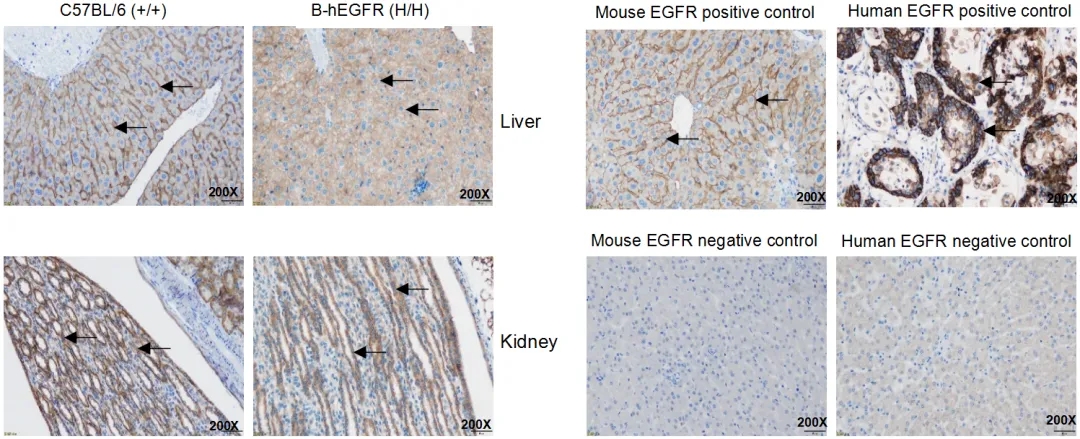
在野生鼠的肝脏和肾脏中检测到小鼠EGFR蛋白表达,在B-hEGFR小鼠中检测到人EGFR蛋白表达。箭头表示EGFR染色阳性的组织细胞(棕色)。
血常规/生化分析
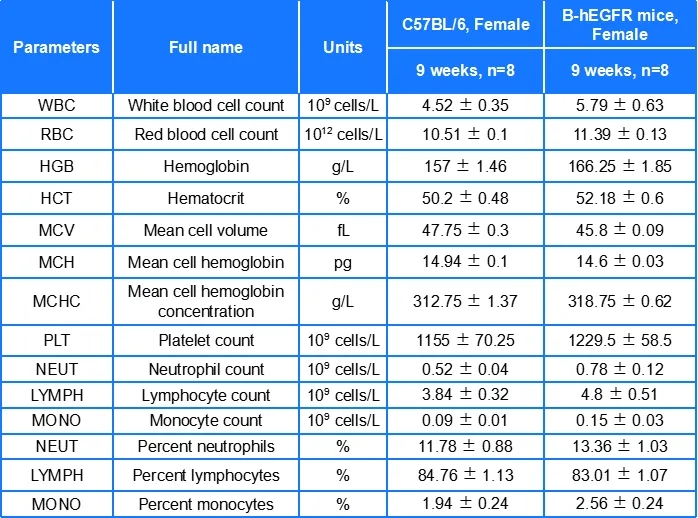
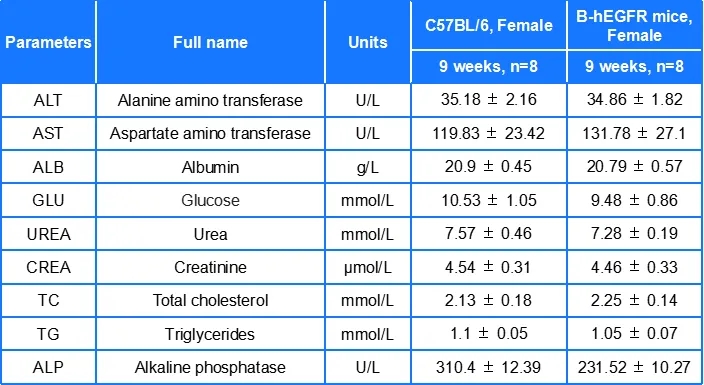
B-hEGFR小鼠各项血液参数与野生型小鼠相似,表明EGFR人源化没有影响小鼠血细胞的发育及生化指标。数值以平均值±SEM表示。
肿瘤生长曲线及体重变化
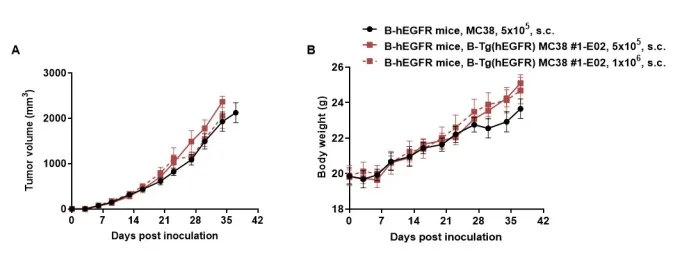
将B-Tg(hEGFR) MC38细胞(5×105,1×106)和野生型MC38细胞(5×105)皮下植入纯合子B-hEGFR小鼠(雌性,6-9周龄,n=6)。每周2次测量肿瘤体积和体重。(A)平均肿瘤体积±SEM。(B)体重(Mean±SEM)。如图所示,B-Tg(hEGFR) MC38细胞在体内能够形成肿瘤,可用于疗效研究。体积以mm3表示,公式为:V=0.5×长径×短径2
肿瘤细胞蛋白表达分析
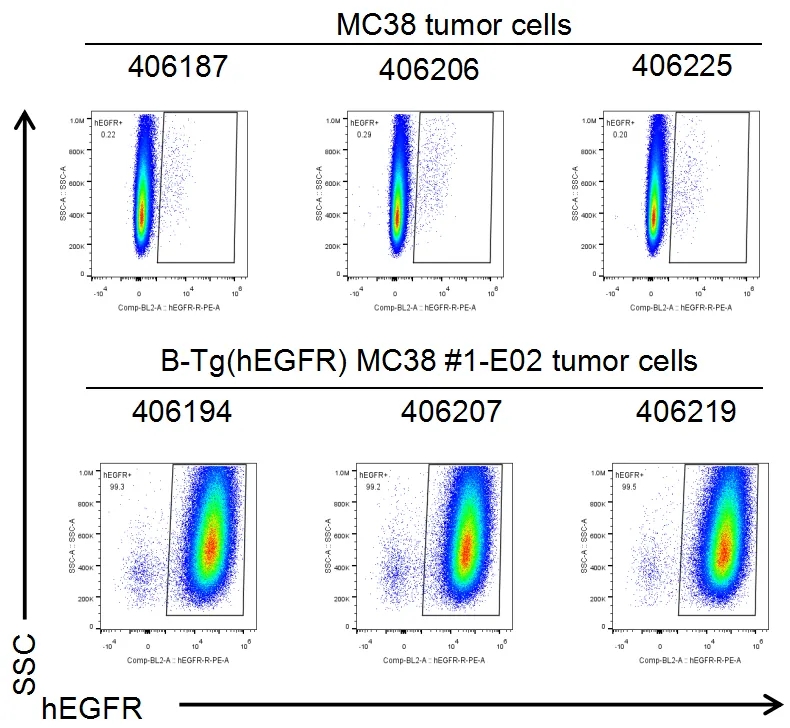
结试验时,取肿瘤组织检测人EGFR的表达情况,如图所示,人EGFR在肿瘤细胞表面高表达。
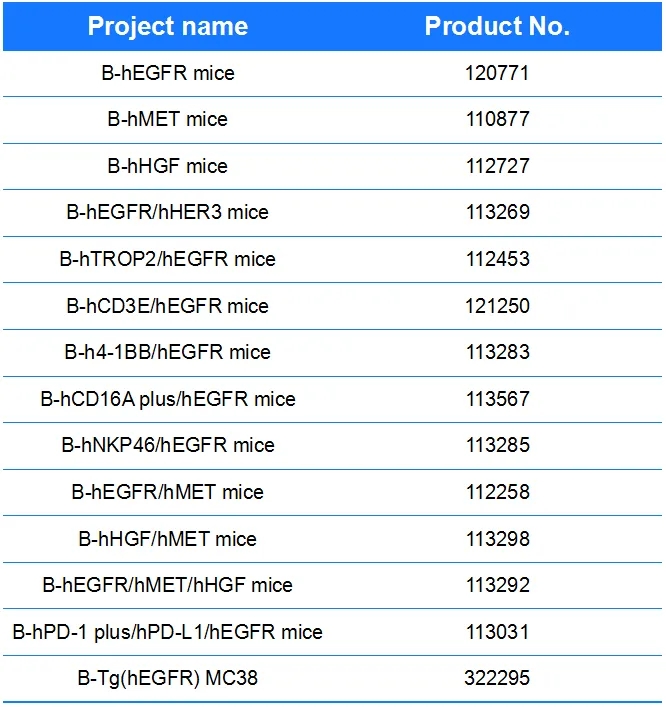
相关产品列表
参考资料:
[1] Kafkova LR, Mierzwicka JM, Chakraborty P, et al. NSCLC: from tumorigenesis, immune checkpoint misuse to current and future targeted therapy[J]. Front Immunol. 2024 Feb 7:15:1342086.
[2] Cai WQ, Zeng LS, Wang LF, et al. The Latest Battles Between EGFR Monoclonal Antibodies and Resistant Tumor Cells. Front Oncol. 2020;10:1249. Published 2020 Jul 24. doi:10.3389/fonc.2020.01249
[3] He J, Huang Z, Han L, et al. Mechanisms and management of 3rdgeneration EGFRTKI resistance in advanced nonsmall cell lung cancer[J]. International journal of oncology, 2021, 59(5): 1-20.
[4] Hong S, Gao F, Fu S, et al. Concomitant genetic alterations with response to treatment and epidermal growth factor receptor tyrosine kinase inhibitors in patients with EGFR- mutant advanced non-small cell lung cancer. JAMA Oncol. 2018;4(5):739-42.
[5] Hang-Ping Yao et al, Progress and challenge in development of biotherapeutics targeting MET receptor for treatment of advanced cancer,Biochim Biophys Acta Rev Cancer . 2020 Dec;1874(2):188425.
[6] Wang Q, Yang S, Wang K and Sun SY: MET inhibitors for targeted therapy of EGFR TKI-resistant lung cancer. J Hematol Oncol 12: 63, 2019.
[7] Drilon A, Cappuzzo F, Ou SI and Camidge DR: Targeting MET in lung cancer: Will expectations finally Be MET? J Thorac Oncol 12: 15-26, 2017.
[8]Yun J, Lee SH, Kim SY, Jeong SY, Kim JH, et al. Antitumor Activity of Amivantamab (JNJ-61186372), an EGFR-MET Bispecific Antibody, in Diverse Models of EGFR Exon 20 Insertion-Driven NSCLC. Cancer Discov. 2020 Aug;10(8):1194-1209.