您可能也喜欢
近期在2025ASCO年会上,OSE公布了Tedopi®治疗性癌症疫苗的II期临床数据,12个月总生存率达65%,为癌症患者带来曙光!肿瘤疫苗作为新兴的免疫治疗方法,旨在激活机体的特异性免疫反应,从而识别并清除肿瘤细胞。根据Markets and Markets Research预测,全球肿瘤疫苗将在2032年达到204.7亿美元,复合年增长率8.6%。
肿瘤疫苗通过携带肿瘤抗原(肿瘤相关抗原TAA或肿瘤特异性抗原TSA),被抗原递呈细胞(如树突状细胞DCs)摄取并加工,随后通过主要组织相容性复合体MHC I和MHC II分子递呈给CD8+和CD4+ T细胞,激活肿瘤特异性T细胞。这些T细胞分化为效应T细胞和记忆T细胞,效应T细胞迁移至肿瘤微环境(TME)并通过细胞毒性作用或细胞因子释放(如IFN-γ和TNF-α)直接杀伤肿瘤细胞。此外,疫苗可诱导B细胞介导的体液免疫反应,通过抗体依赖性细胞介导的细胞毒性(ADCC)作用促进肿瘤细胞清除。肿瘤疫苗的终极目标是克服TME中的免疫抑制,维持持续的抗肿瘤免疫反应[1]。
肿瘤疫苗的四大分类
根据制备方式的不同,肿瘤疫苗可分为以下四大类:
细胞疫苗
通常使用DC或肿瘤细胞作为抗原载体,例如FDA批准的首个肿瘤疫苗Sipuleucel-T用于治疗前列腺癌。
病毒疫苗
利用病毒载体(如腺病毒、溶瘤病毒)递送肿瘤抗原,同时激活固有免疫和适应性免疫系统。
肽类疫苗
由特定的肿瘤抗原短肽组成,通常需要结合佐剂来增强免疫原性,如NY-ESO-1疫苗。
核酸疫苗
包括DNA疫苗和mRNA疫苗,能够编码完整的肿瘤抗原并在体内表达,诱导强烈的MHC I介导的CD8+ T细胞反应,且制备简单快速,适合个性化疫苗的开发,例如BioNTech 和Genentech联合开发的Autogene Cevumeran,一种包含20余名患者特异性新抗原组成的个性化mRNA疫苗,2月19日nature发表的期刊中表明,在应答者中诱导的CD8+ T细胞克隆平均估计寿命为7.7年,其中约20%克隆具有数十年的潜伏寿命,展现出持久的抗肿瘤潜力[1,2]。
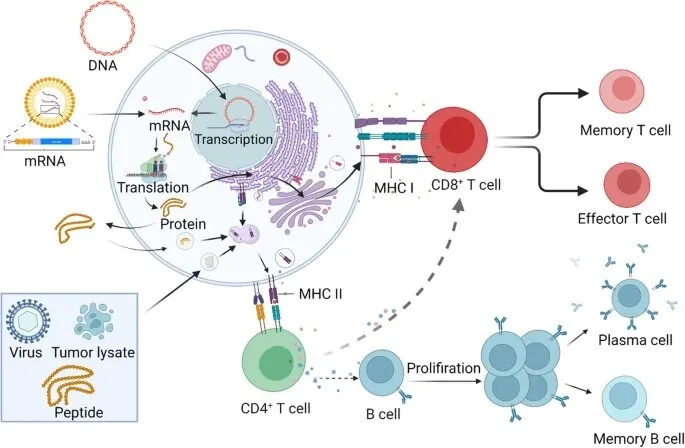
图1.肿瘤疫苗机制的示意图[1]
肿瘤疫苗面临的挑战
尽管肿瘤疫苗在临床试验中展现出潜力,但仍面临诸多挑战。首先,肿瘤微环境具有免疫抑制特性,例如上调PD-L1表达或分泌免疫抑制细胞因子(如TGF-β、IL-10),从而抑制T细胞活性。其次,肿瘤抗原的选择至关重要,但肿瘤相关抗原往往具有低免疫原性,且存在个体差异,使得疫苗效果存在不确定性。此外,肿瘤的高度异质性意味着同一疫苗可能无法适用于所有患者。为了提高疗效,肿瘤疫苗通常与免疫检查点抑制剂(如PD-1/PD-L1抗体)等其他治疗手段联合使用,以克服免疫抑制并增强抗肿瘤应答[1,2]。
三大联合策略破局实体瘤
许多研究表明,肿瘤疫苗与其他疗法的联合应用在癌症治疗中展现出积极的研究进展。
肿瘤疫苗+免疫检查点抑制剂
Moderna与默沙东共同开发的个性化肿瘤疫苗mRNA-4157 (V940),包含编码多达34种新抗原的单一合成mRNA分子,并正在进行与帕博利珠单抗联合治疗高危黑色素瘤患者的3期临床试验,2期临床试验3年随访数据显示,联合疗法显著改善了患者的无复发生存期(RFS),将复发或死亡风险降低了49%,有望成为获批上市的首款mRNA肿瘤疫苗。
肿瘤疫苗+CD3双特异性抗体(CD3 bsAb)
联合治疗能够显著增强T细胞在实体瘤中的浸润和激活,从而改善治疗效果。疫苗诱导的T细胞浸润,尤其是通过CXCR3介导的T细胞迁移,能够将T细胞引导至肿瘤边缘,而CD3 bsAb则进一步激活这些T细胞,促使其深入肿瘤核心,发挥更强的抗肿瘤效应。这种联合治疗策略不仅增强了T细胞的杀伤能力,还重塑了肿瘤微环境,使其向促炎性方向转变,从而在多种实体瘤模型中显著延缓肿瘤生长并提高生存率。
肿瘤疫苗+细胞治疗
Darrell J. Irvine教授团队开发的 “amph-ligand”疫苗策略,直接刺激CAR-T细胞在淋巴结微环境中的活性,显著增强了CAR-T细胞的扩增和功能。这种联合治疗在多种免疫活性小鼠肿瘤模型中表现出增强的抗肿瘤效果,能够显著延缓肿瘤生长并延长生存期[3]。此外,BNT211是由BioNTech开发的一款CAR-T细胞疗法,包含CLDN6自体CAR-T和编码CLDN6抗原的RNA疫苗CARVac,在实体瘤I/II期临床试验中展示出积极的结果。
肿瘤疫苗研发火热,中国战队冲刺全球赛道
截至2025年6月,全球FDA/EMA批准上市的治疗性肿瘤疫苗数量仅有1款。 在国际上,主要从事肿瘤疫苗研发的企业包括Moderna、BioNTech、Elicio Therapeutics、CureVac和赛诺菲(Sanofi)等。在中国,肿瘤疫苗研发也取得了显著进展。例如,云顶新耀于2024年8月宣布启动一款个性化mRNA肿瘤治疗性疫苗EVM16的临床试验。 此外,嘉辰西海生物公司研发的肿瘤新抗原mRNA疫苗JCXH-211,也获得FDA的临床试验申请批准。其他活跃在肿瘤疫苗研发领域的中国企业还包括立康生命、康希诺生物、威斯津生物、纽安津生物、澄实生物、因诺纬克生物和康德赛等。
HLA分型-肿瘤疫苗设计的关键角色
人类白细胞抗原(HLA)分型在肿瘤疫苗的设计和效果评估中起着关键作用, HLA是编码人MHC的基因簇,位于6号染色体短臂,负责将抗原片段呈递给T细胞以激活免疫应答。其机制分为两类:
• HLA-I类分子:分布于所有有核细胞表面,主要递呈内源性抗原(如病毒或肿瘤突变蛋白),包括经典I类基因HLA-A、-B、-C和非经典I类基因HLA-E、-G、-F。抗原经蛋白酶体降解后,通过TAP转运至内质网,与HLA-I类分子结合成复合物,转运至细胞表面供CD8⁺ T细胞识别并杀伤异常细胞。
• HLA-II类分子:表达于抗原呈递细胞(如树突状细胞),递呈外源性抗原(如细菌蛋白),包括经典II类基因HLA-DP 、-DQ、-DR参与递呈外源性抗原,以及非经典II类基因: LMP、TAP、HLA-DM、HLA-DO 参与抗原的加工和转运。抗原被吞噬后经溶酶体处理,与HLA-II类分子结合,激活CD4⁺ T细胞以协调体液和细胞免疫。
理想的肿瘤抗原应具有与HLA分子高亲和力的结合能力,以确保其能够有效递呈并激活T细胞。例如,新抗原疫苗的开发依赖于对患者肿瘤基因组的测序和HLA分型,以预测哪些突变产生的抗原能够与患者的HLA分子结合并引发免疫反应。此外,HLA分型还影响肿瘤疫苗的个性化设计。由于HLA分子的多态性,不同患者对同一抗原的免疫反应可能存在显著差异。因此,在开发个性化肿瘤疫苗时,必须考虑患者的HLA基因型,以确保疫苗中的抗原能够被有效递呈。为了提高疫苗的普适性,研究人员正在探索包含多个HLA限制性抗原的疫苗设计,以覆盖更广泛的患者群体[2, 4]。HLA基因在不同人群中存在高度多态性,其等位基因频率因种族和地理区域而异。HLA I类基因中:亚洲人群高表达HLA-A11、HLA-B46,欧美人群则以HLA-A02、HLA-B07为主。欧美的白种人HLA-A*02:01频率最高,中国人HLA-A*11:01频率最高,而日本人HLA-A*24:02频率最高。
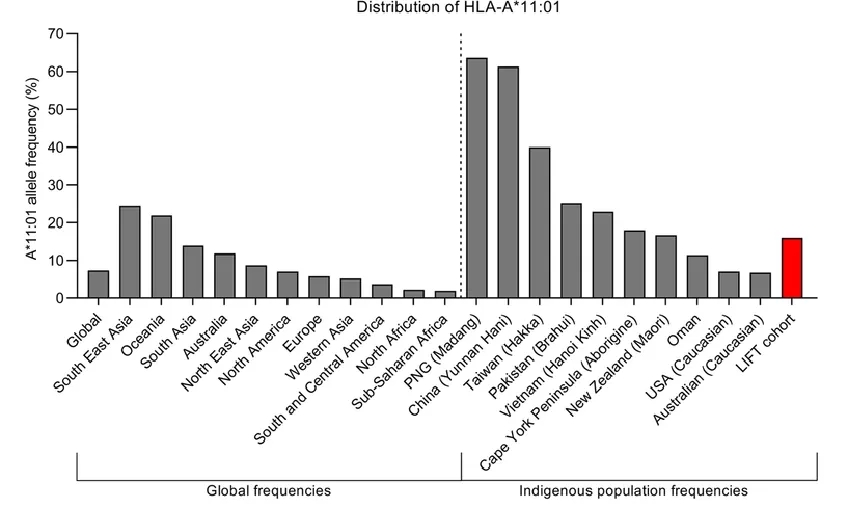
图2.HLA-A*11:01的分布频率
B-HLA-A11.1小鼠验证数据,助力亚洲患者精准治疗探索
针对肿瘤疫苗的作用机制,百奥赛图开发了一系列HLA人源化小鼠,助力肿瘤疫苗的临床前评价。本次以B-HLA-A11.1小鼠(产品编号:112803)为例:
检测B-HLA-A11.1小鼠中由疫苗诱导的免疫反应
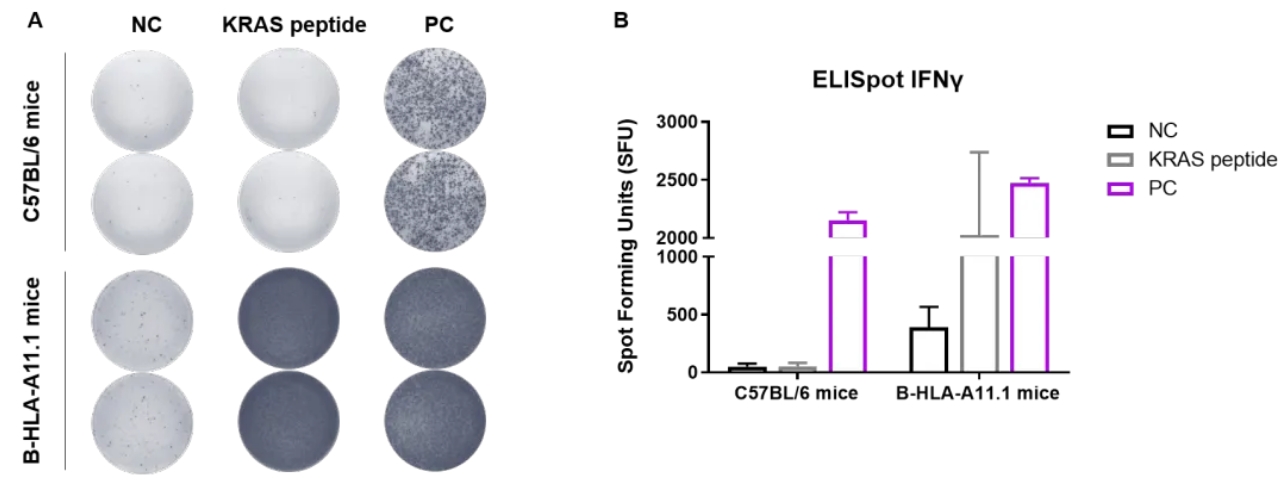
将C57BL/6小鼠和B-HLA-A11.1小鼠(雌性、7-8周龄)分成PBS和KRAS肽组(n=2),分别在腿部肌肉接种PBS或疫苗。在最后一次接种的3周后,取小鼠脾细胞分别用抗原肽、PBS (阴性对照)或CD3(阳性对照)刺激,然后测量IFN-γ分泌。未观察到小鼠体重的明显变化(数据未展示)。(A)代表性图片,(B)数据汇总。结果显示,B-HLA-A11.1小鼠是进行疫苗体内评估的有力模型。
KRAS*G12V mRNA疫苗在同种移植肿瘤模型中的抗肿瘤活性NEW
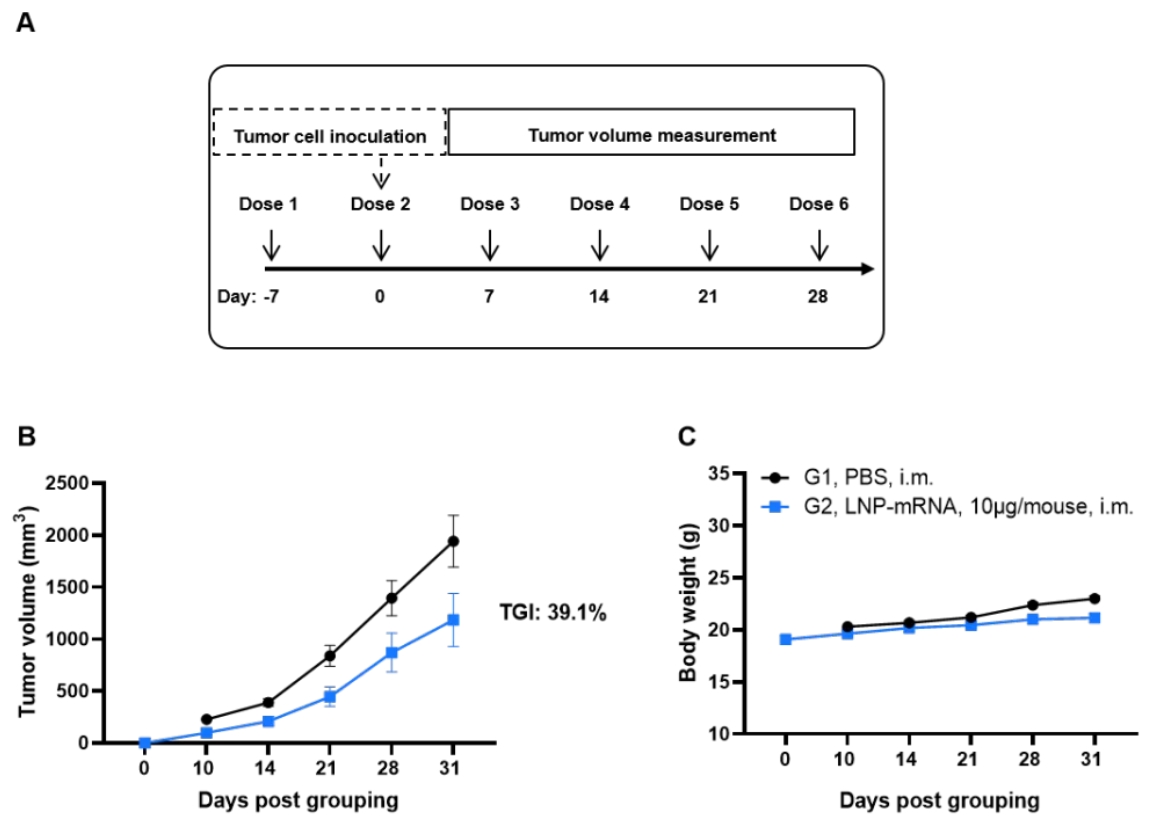
(A)实验示意图。(B) mRNA疫苗治疗的抗肿瘤活性。B-HLA-A11.1小鼠(每组n = 10)分别接种PBS或LNP-mRNA。实验第0天,将1 × 10⁶个B-HLA-A11.1/hKRAS*G12V MC38肿瘤细胞皮下接种于B-HLA-A11.1小鼠右侧腹股沟部位,并于第-7、0、7、14、21和28天通过肌肉注射(i.m.)分别给予PBS或mRNA疫苗,共接种六次。如图B所示,mRNA疫苗显著抑制了肿瘤生长,并与对照组相比显著延长了总体生存期。(C) 观察肿瘤生长期间的小鼠体重变化。数据以平均值 ± 标准误(SEM)表示。注:LNP-mRNA由客户提供。
KRAS*G12V mRNA疫苗在同种移植肿瘤模型中的抗肿瘤活性NEW
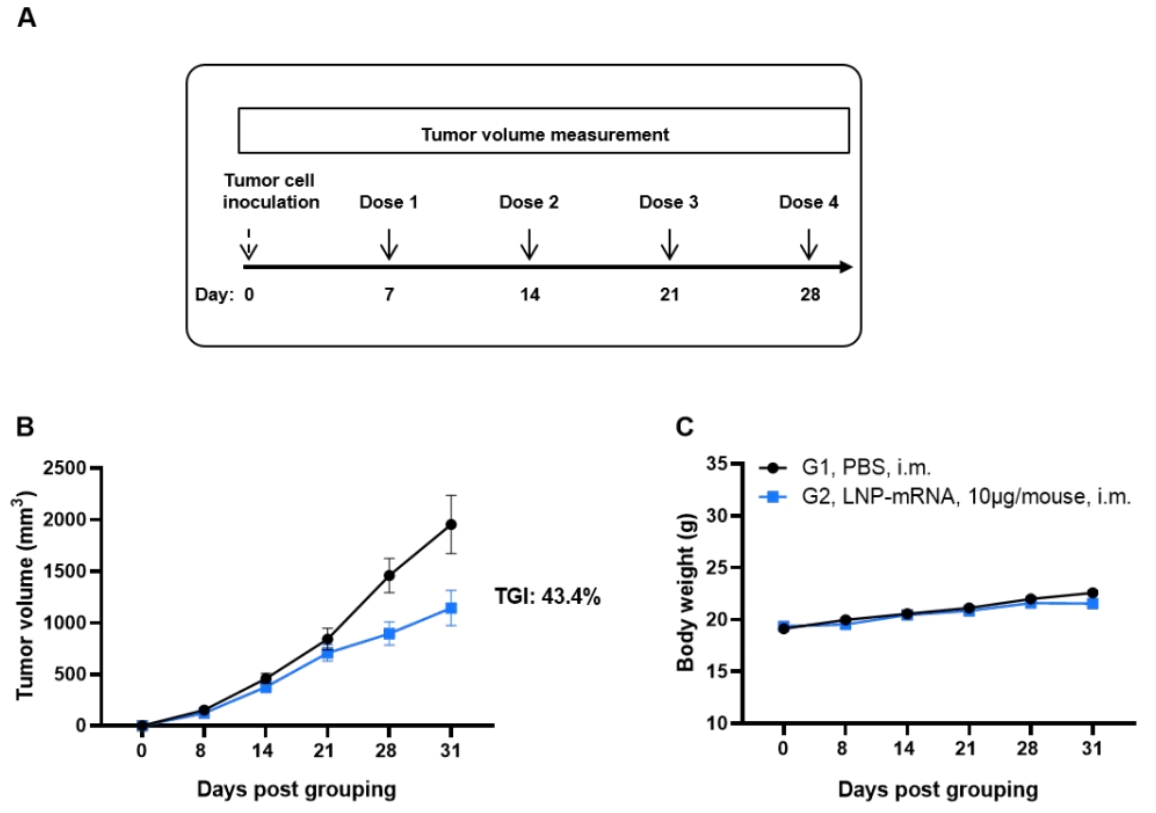
(A) 实验示意图。(B) mRNA疫苗治疗的抗肿瘤效果。B-HLA-A11.1小鼠(每组n = 9)接种PBS或LNP-mRNA。在肿瘤体积达到约100 mm³后,于小鼠右侧背部皮下接种1 × 10⁶个B-HLA-A11.1/hKRAS*G12V MC38肿瘤细胞,并分别在第7、14、21和28天,通过肌肉注射(i.m.)给予PBS或mRNA疫苗,每周一次,共接种四次。如图B所示,mRNA疫苗显著抑制了肿瘤生长,并与对照组相比显著延长了总体生存期。(C) 肿瘤生长观察期间的小鼠体重变化。数据以平均值 ± 标准误(SEM)表示。注:LNP-mRNA由客户提供。
KRAS*G12V mRNA疫苗在同种移植肿瘤模型中的抗肿瘤活性NEW
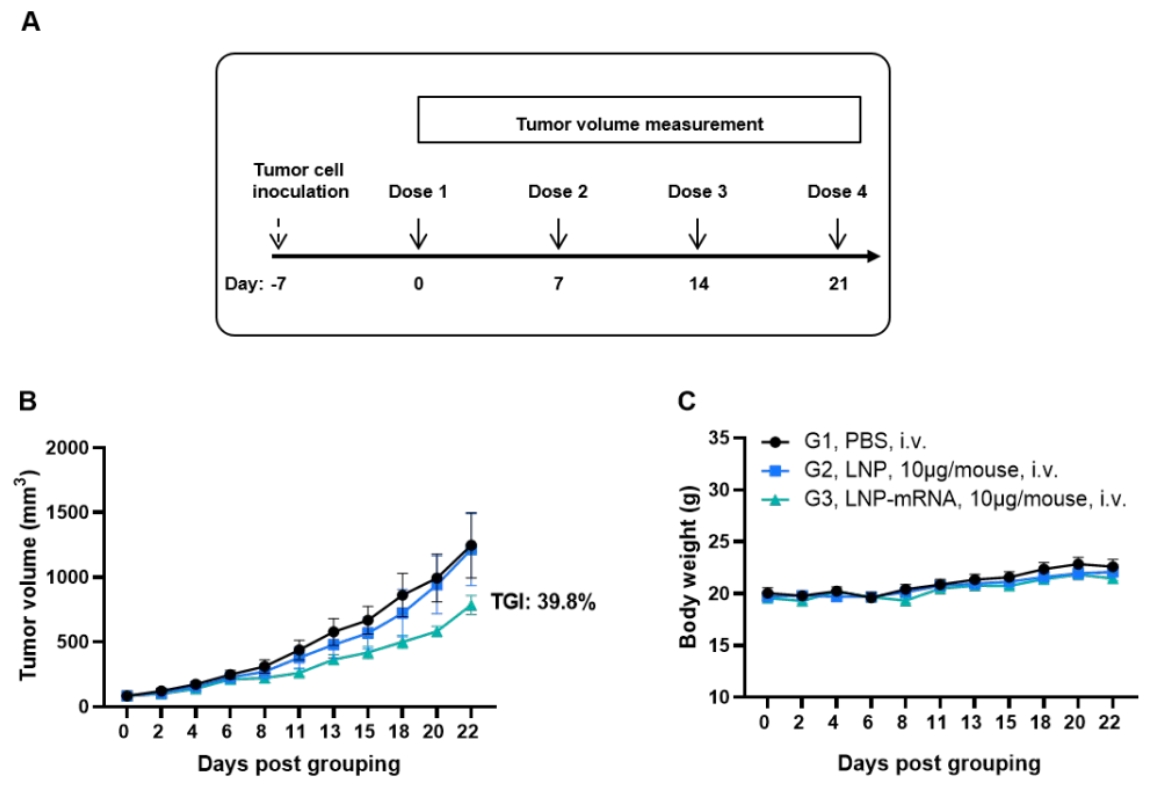
(A) 实验示意图。(B) mRNA疫苗治疗的抗肿瘤效果。B-HLA-A11.1小鼠(n = 8)分别接种PBS、LNP或LNP-mRNA。在肿瘤体积达到约100 mm³后,于小鼠右侧背部皮下接种1 × 10⁶个B-HLA-A11.1/hKRAS*G12V MC38肿瘤细胞,并于第0、7、14和21天通过静脉注射(i.v.)给予PBS、LNP或mRNA疫苗,每周一次,共接种四次。如图B所示,mRNA疫苗显著抑制了肿瘤生长,并与对照组相比显著延长了总体生存期。(C) 肿瘤生长观察期间的小鼠体重变化。数据以平均值 ± 标准误(SEM)表示。
上述药效结果表明,B-HLA-A11.1小鼠是体内评估mRNA疫苗药效的有力临床前模型。
B-HLA-A11.1小鼠器官的组织病理学分析
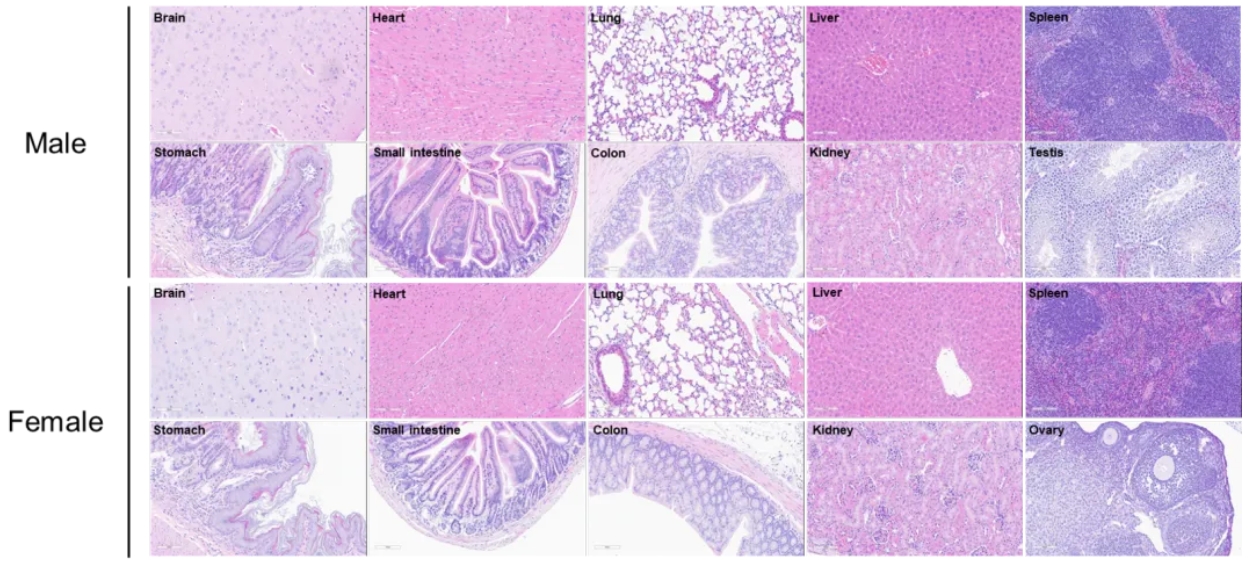
在B-HLA-A11.1小鼠8周龄时分离其主要器官,并通过H&E染色进行分析(雄性,n=10;雌性,n=10)。结果显示,所有器官(包括脑、心脏、肺、肝、脾、胃、小肠、结肠、肾、卵巢和睾丸)均未发现明显异常。比例尺:100微米。
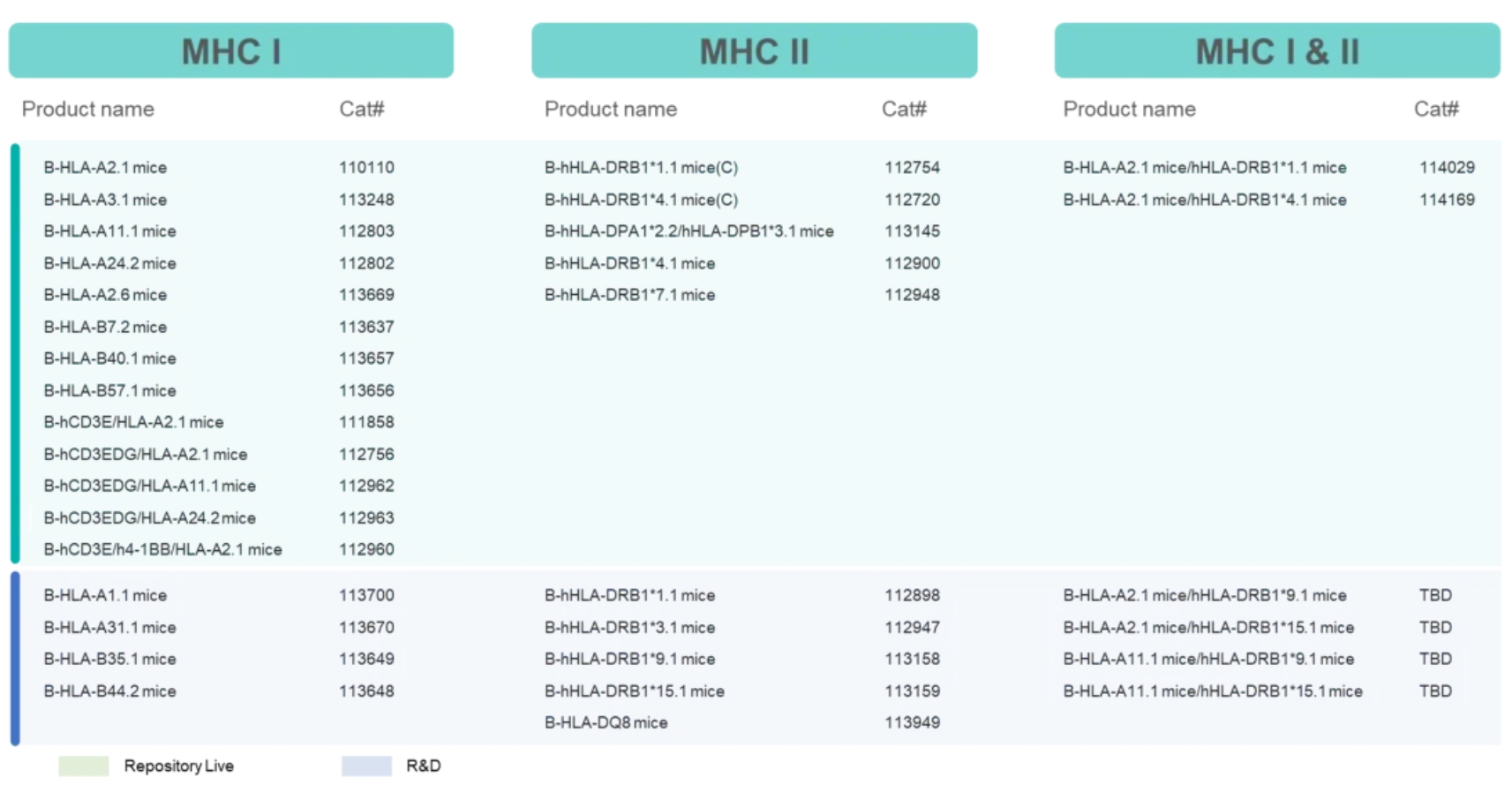
百奥赛图HLA人源化小鼠模型列表
除HLA-A11.1外,百奥赛图还开发了一系列HLA人源化小鼠模型,助力肿瘤疫苗等创新疗法的研究。
相信伴随科研工作的不断深入与技术创新的持续突破,肿瘤疫苗研究领域将持续火热,在精准医疗时代开启新的篇章。我们也将持续开发更具价值的模型工具,为癌症治疗打开更多可能。
参考资料
[1] Liu J, Fu M, Wang M, et al. Cancer vaccines as promising immunotherapeutics: platforms and current progress. J Hematol Oncol. 2022;15(28).
[2] Hollingsworth RE, Jansen K. Turning the corner on therapeutic cancer vaccines. npj Vaccines. 2019;4(7).
[3] Ma, L., Dichwalkar, T., Chang, J. Y. H., et al. (2019). Enhanced CAR-T cell activity against solid tumors by vaccine boosting through the chimeric receptor. Science, 365(6449), 162–168.
[4] Saxena, M., van der Burg, S. H., Melief, C. J. M., & Bhardwaj, N. (2021). Therapeutic cancer vaccines. Nature Reviews Cancer, 21(6), 360-378.
[5] https://www.biontech.com/content/dam/corporate/images/newsroom/fact-sheets/BNT211_FactSheet.pdf