实验结果
肝癌原位模型:B-luc Hep 3B 在 B-NDG 小鼠中的应用
肝癌原位模型的建立
| Study ID: |
Groups |
Animal strain |
Sex |
Cell line |
The amount of
cells Inoculated |
The Volume
of cells |
Animal number |
Remarks |
| TT02110 |
- |
B-NDG mice |
F |
B-luc Hep 3B #1-A06 |
5×105 |
0.02ml/mice |
10 |
- |
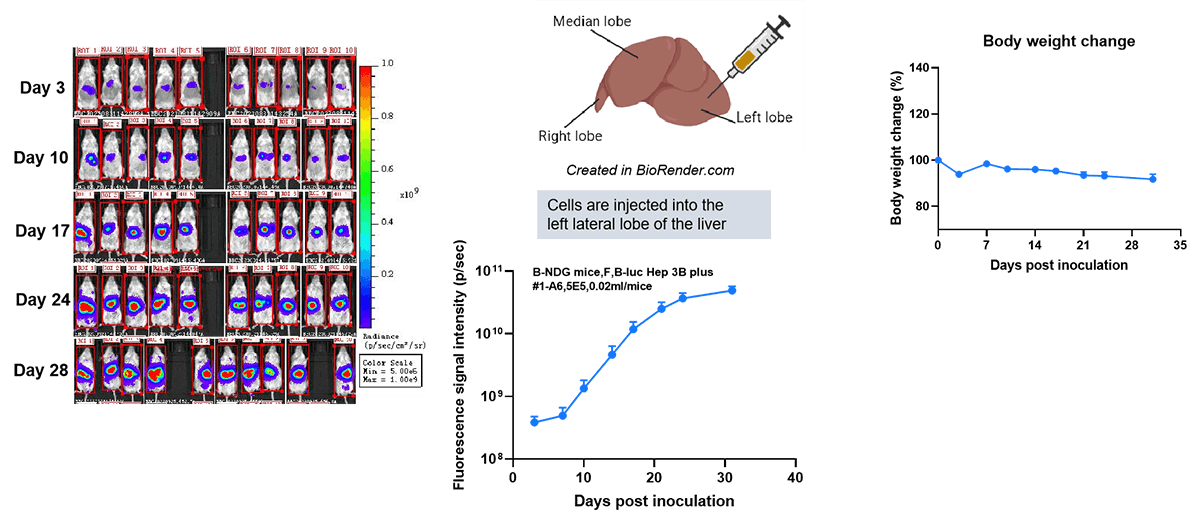
肝癌原位模型的构建。
为构建肝癌模型,取 20 微升 B-luc Hep 3B 细胞悬液(细胞数 5×10⁵个),注射至 B-NDG 小鼠(雌性,每组 10 只)的肝左外叶。每周记录小鼠的体重及肿瘤荧光信号变化。结果显示,随时间推移,小鼠体内肿瘤荧光信号逐渐增强,体重则出现轻微下降。这表明该细胞株已成功构建为肝癌原位移植瘤模型。
肝癌原位模型的 Micro-CT 成像
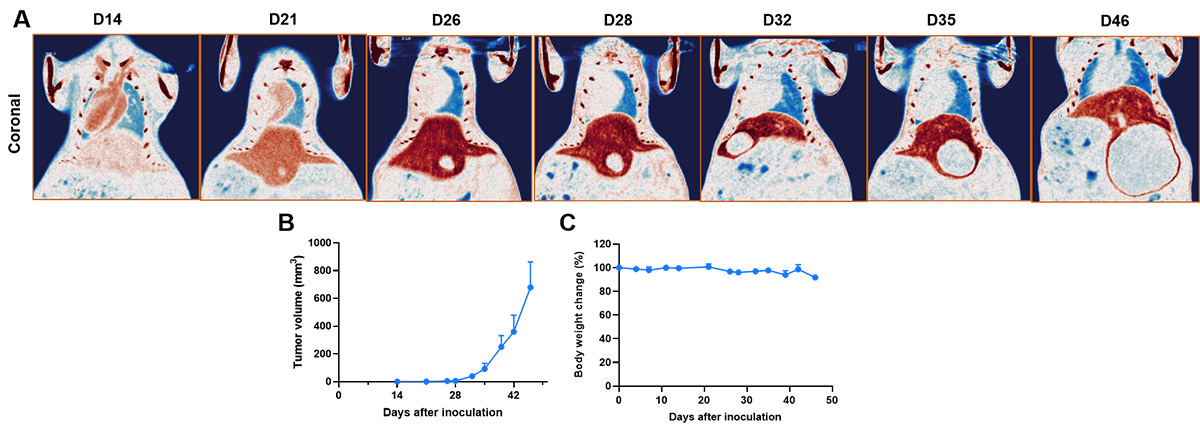
基于显微计算机断层扫描(Micro-CT)的肝癌原位模型影像学分析。
影像学结果显示,造影剂注射后,小鼠肝脏组织密度增高,在影像上呈现为高密度(深棕色)阴影;而肿瘤组织几乎不摄取造影剂,表现为低密度阴影。A:对 B-NDG 小鼠接种 B-Luc-Hep 3B 细胞建立的肝癌原位模型,于接种后第 14 天进行 Micro-CT 扫描,图像为小鼠腹部冠状面。结果可见,随时间推移,肝脏区域的低密度阴影(肿瘤组织)体积逐渐增大。B:通过增强 CT 扫描数据绘制肿瘤生长曲线。C:B-Luc-Hep 3B 肝癌原位模型小鼠的体重变化趋势。
肝癌原位模型的疗效评估
| Study ID: |
Groups |
Animal number |
Treatment |
Dosage(mg/kg) |
Lot No. |
Dosing Volume |
Dosing Route |
Treatment Schedule |
Treatment Times |
| 21P079544 |
G1 |
6 |
0.9% saline solution |
- |
2106261604 |
10μL/g |
i.p. |
QW |
4 |
| G2 |
6 |
fluorouracil |
60mg/kg |
2110151 |
10μL/g |
i.p. |
QW |
4 |
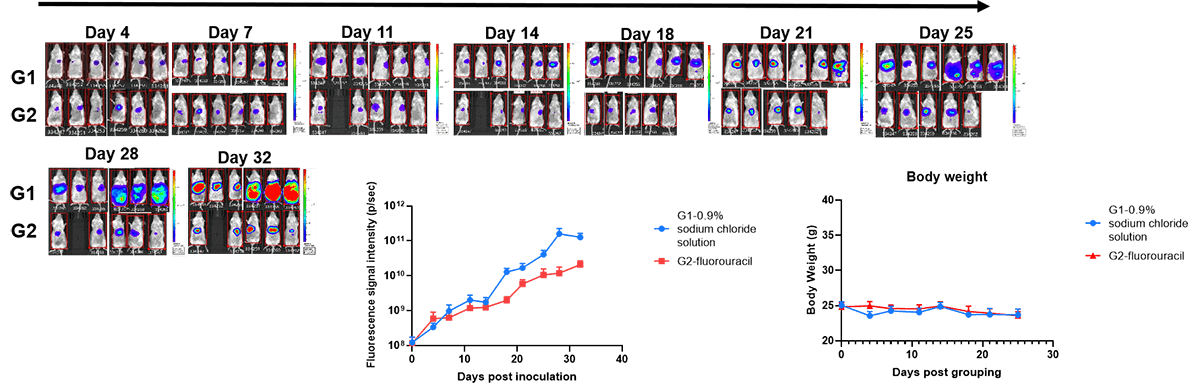
肝癌原位模型的药效评价。取 B-NDG hIL-15 小鼠(雌性,每组 10 只),接种 20 微升细胞悬液(细胞数 5×10⁵个)。肿瘤接种后第 5 天,依据活体成像信号值将小鼠随机分为 0.9% 生理盐水对照组与氟尿嘧啶给药组。每周记录小鼠的体重及肿瘤荧光信号变化。结果显示,60 毫克 / 千克剂量的氟尿嘧啶可显著抑制 B-luc Hep 3B 肝癌原位移植瘤的生长,表明该模型可有效用于临床前药效评价。实验结束后对小鼠进行解剖,苏木精 - 伊红(H&E)染色结果显示,肿瘤已转移至胰腺、胃及脾脏组织。
肝免疫重建模型的疗效评估
| Study ID: |
Groups |
Animal number |
Treatment |
Dosage(mg/kg) |
Lot No. |
Dosing Volume |
Dosing Route |
Treatment Schedule |
Treatment Times |
| 22P122201 |
G1 |
6 |
PBS |
- |
2428708 |
5μL/g |
i.v. |
QW |
4 |
| G2 |
6 |
Positive control |
0.5mg/kg |
2022105025 |
5μL/g |
i.p. |
Q2D |
10 |
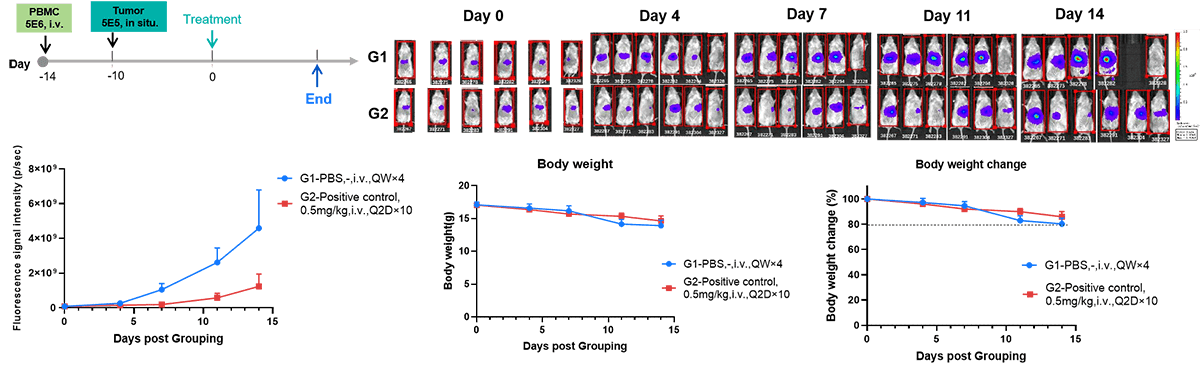
肝癌原位免疫重建模型的药效评价。对 B-NDG 小鼠静脉注射人外周血单个核细胞(PBMC,5×10⁵个 / 0.2 毫升 / 只),第 4 天时于小鼠肝脏接种 20 微升 B-luc Hep 3B 细胞悬液(5×10⁶个 / 0.02 毫升 / 只)。实验第 0 天,依据平均成像信号值及人源 CD45 阳性细胞比例(hCD45%)将小鼠随机分为两组,每周记录小鼠的体重及肿瘤荧光信号变化。结果显示,阳性对照药可显著抑制免疫重建后肝癌原位移植瘤的生长,且小鼠体重随时间推移仅出现轻微下降,表明该模型可有效用于临床前药效评价。
肝癌原位模型:B-Tg(Luc-EGFP) Hep G2 在 B-NDG 小鼠中的应用
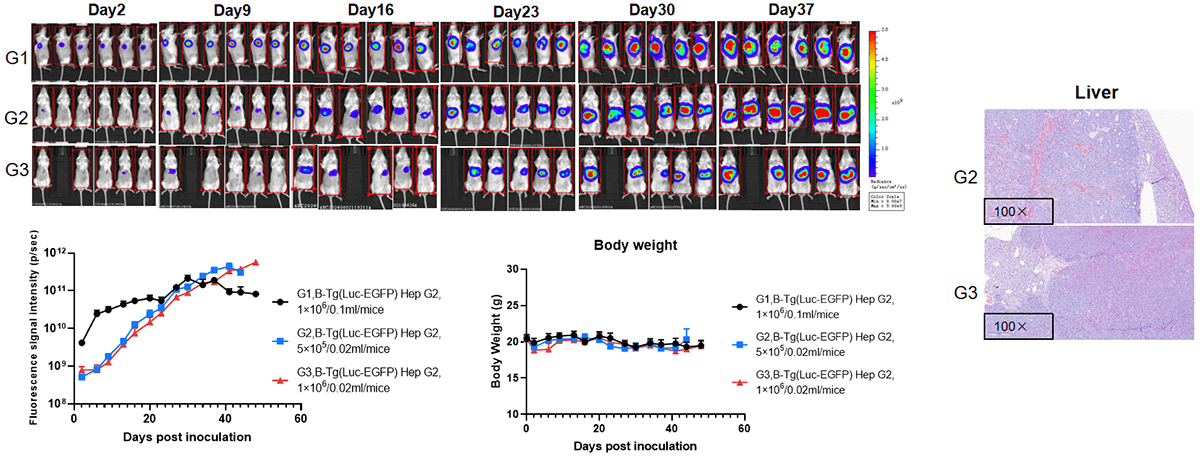
建立肝癌原位模型。
为了建立肝癌模型,将 B-Tg(Luc-EGFP) Hep G2 细胞悬液注射到 B-NDG 小鼠左侧肝叶,并每周记录小鼠的体重和肿瘤荧光信号。结果表明,荧光信号逐渐增加。右面板显示了肝肿瘤的 H&E 染色结果。此表明该细胞系成功构建为肝癌原位肿瘤模型。
肝脏转移模型- 半脾注射
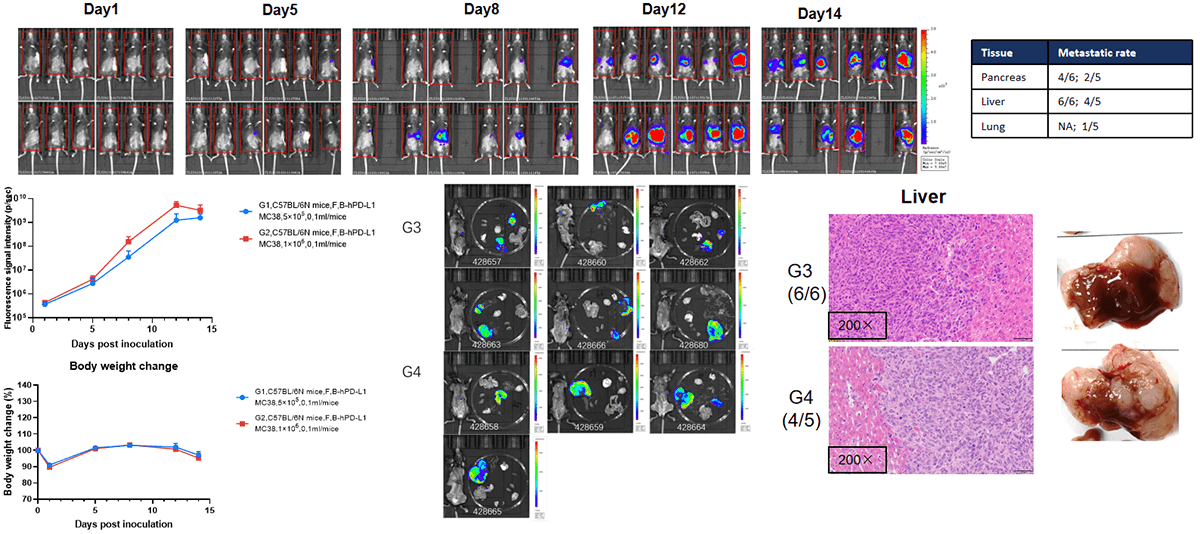
建立肝脏转移模型。为了建立肝脏转移模型,将 100 μL B-hPD-L1 MC38 细胞悬液(5×105,1×106)注射到 B-NDG 小鼠的脾脏,每周记录小鼠的体重和肿瘤荧光信号。结果表明,荧光信号逐渐增加。此表明该细胞系成功构建为肝脏转移模型。
| Study ID: |
Groups |
Animal number |
Treatment |
Dosage (mg/kg) |
Lot No. |
Dosing Volume |
Dosing Route |
Treatment Schedule |
Treatment Times |
| 24P071531 |
G1 |
6 |
PBS |
- |
2933643 |
10μL/g |
i.v. |
QW |
2 |
| G2 |
6 |
DS-8201 |
3mpk |
394042 |
10μL/g |
i.v. |
QW |
2 |
| G3 |
6 |
DS-8201 |
6mpk |
394042 |
10μL/g |
i.v. |
QW |
2 |
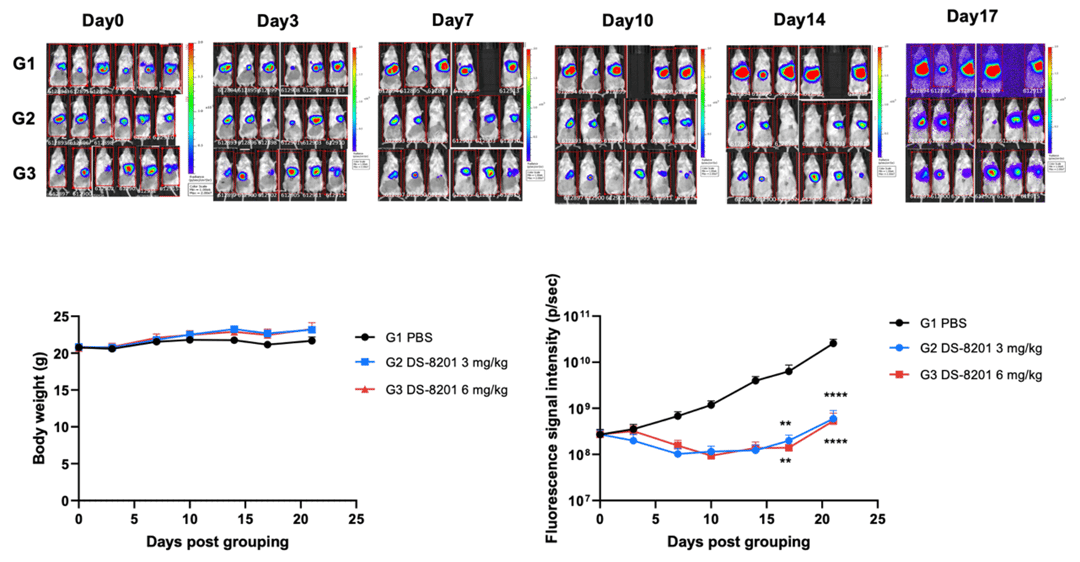
DS-8201 可显著抑制 B-NDG 小鼠体内 B-Tg (Luc-EGFP) Hep G2 肿瘤的生长。将 5×10⁵个 Hep G2 细胞与基质胶按 1:1 比例混合后,原位接种至雌性 B-NDG 小鼠(8 周龄,每组 6 只)。当活体成像信号值达到约 2.7×10⁸光子 / 秒时开始给药,给药方案详见上图。实验数据以平均值 ± 标准误表示。






