FcRn生物机制简介
FcRn(新生儿Fc受体)最初在新生大鼠肠道中被发现,其功能是将母乳中的IgG抗体通过肠上皮细胞转运至新生儿血液,使新生儿获得被动免疫。后续研究发现,人类胎盘中的合体滋养层同样表达FcRn,能够将母体循环中的IgG转运至胎儿毛细血管,实现母体抗体在产前向胎儿的传递。
FcRn的免疫功能主要依赖于其pH依赖性的配体结合特性,具体表现为两种机制:被动免疫功能通过回收和转胞吞作用,拯救单体IgG免于降解并促进其跨细胞转运;而主动免疫功能则通过介导IgG-免疫复合物的参与,激活并增强先天性和适应性免疫应答。在血管内皮细胞中,FcRn能选择性识别内吞的IgG,并将其重新释放至血液循环,显著延长IgG的半衰期。
这种独特的pH依赖性结合机制表现为:在酸性环境(pH 6.0-6.5)如内体中,FcRn与IgG紧密结合;当转运至微碱性(pH 7.35-7.45)的细胞外环境时,二者迅速解离,从而完成IgG的“回收”过程。
此外,靶向FcRn的免疫治疗也在临床中展现出广阔前景。通关清除致病性IgG以减轻神经肌肉传递的干扰,FcRn抑制剂已被用于治疗重症肌无力。目前已有2 款FcRn抑制剂获得FDA批准上市,分别是罗泽利昔珠单抗和艾加莫德。
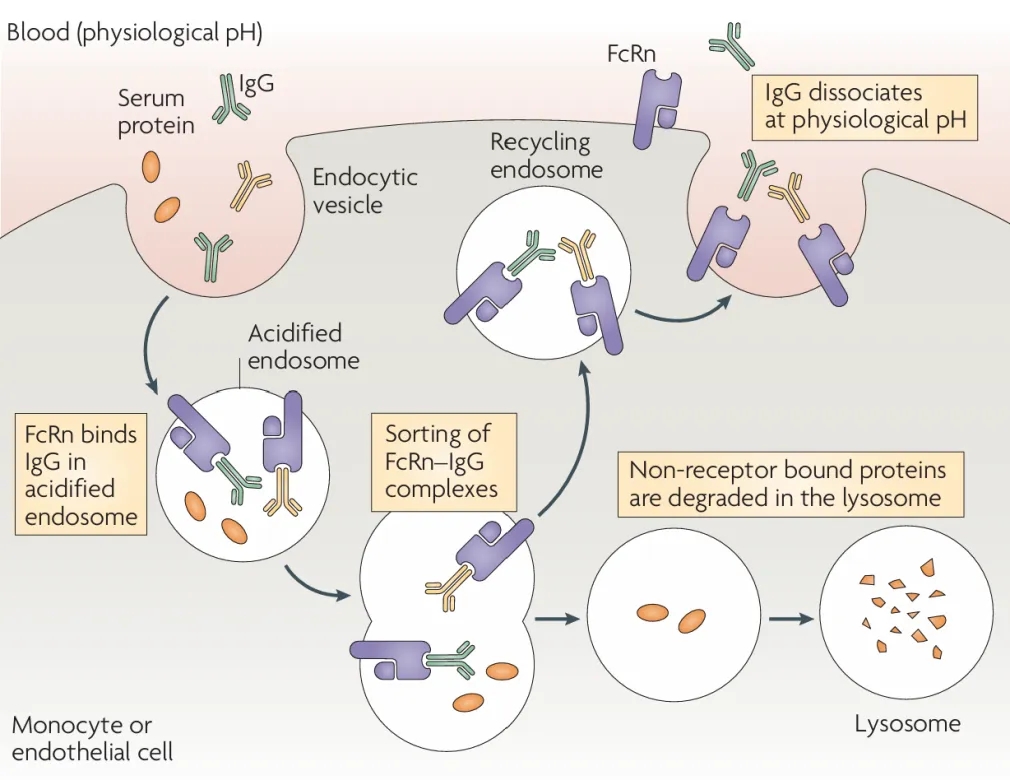
图1:FcRn介导的IgG循环保护作用[1]
FcRn与抗体药代动力学
抗体药物的PK受多种因素影响,包括电荷、类型、分子量、亲和力、pH依赖的FcRn结合亲和力、靶点介导的药物消除机制,糖基化以及抗药抗体等。文献报道,人源抗体与小鼠mFcRn在体内的亲和力一般较人类hFcRn更高,因此IgG在小鼠体内表现出更长的半衰期。这种差异可能在新药开发早期阶段的非临床PK研究中影响模型的转化效果,从而在预测人体PK时产生一定的误差。
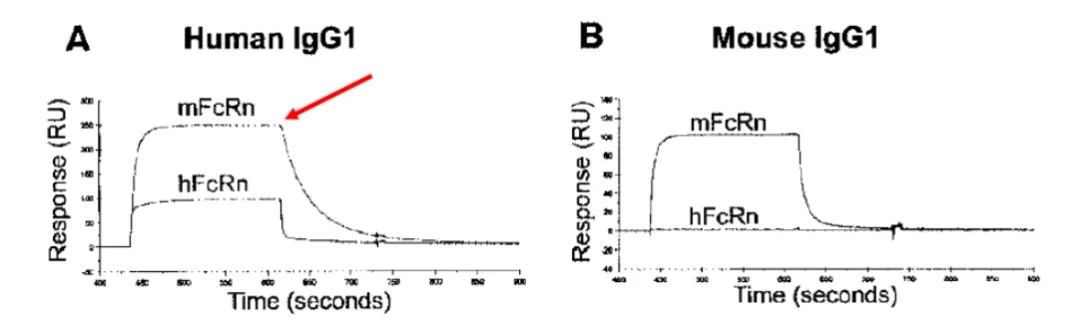
图2:人鼠FcRn结合力差异[2]
百奥动物利用自身稳定可靠的基因编辑技术,对小鼠FcRn进行全人源化,与人体PK特点更为接近,避免上述mFcRn对人源IgG 抗体的影响。目前B-hFcRn(H/H)小鼠品系助力抗体新药PK研发并积累了丰富的成功案例数据。
01、RT-PCR和WB水平验证
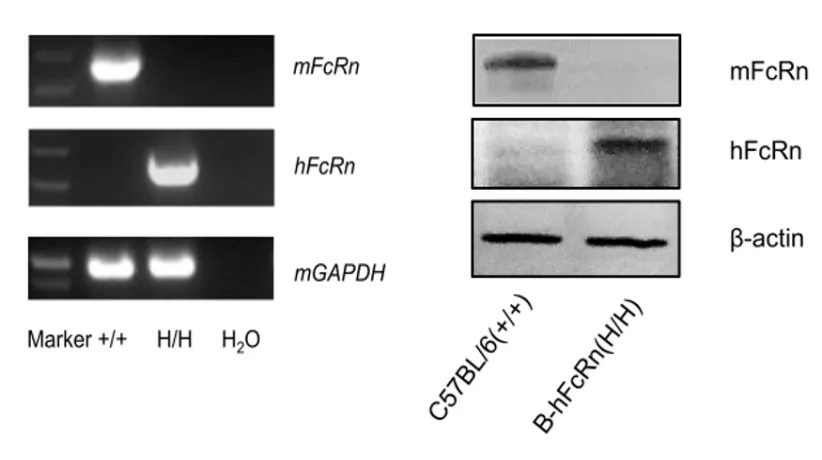
图3:B-hFcRn小鼠的RT-PCR和WB水平验证
02、血药浓度曲线
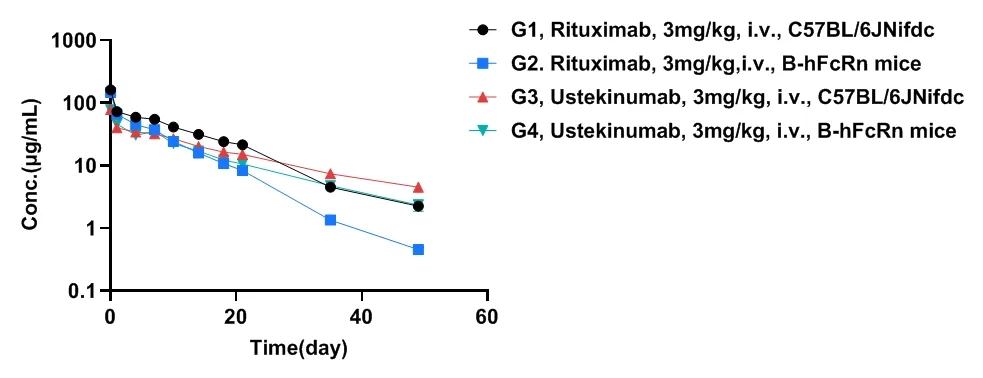
图4:Rituximab和Ustekinumab抗体在C57BL和B-hFcRn小鼠中的血药浓度曲线
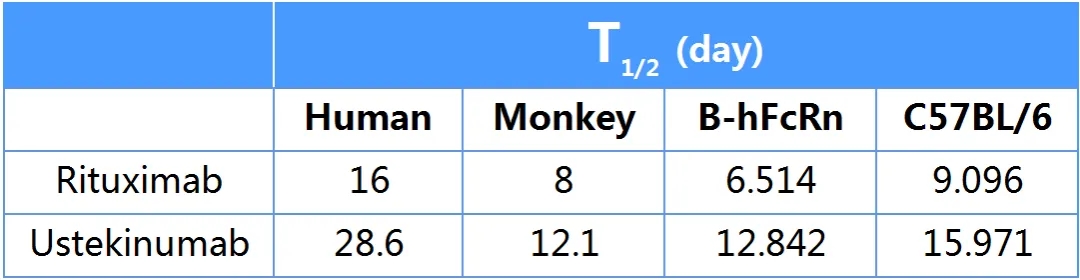
表1: 市售Rituximab和Ustekinumab抗体的半衰期。B-hFcRn小鼠中的上市抗体半衰期较野生型小鼠明显缩短(Rituximab 6.51 vs 9.10 day;Ustekinumab 12.84 vs 15.97 day),与猴的半衰期数据更为接近,临床预测价值更高(内部数据)。
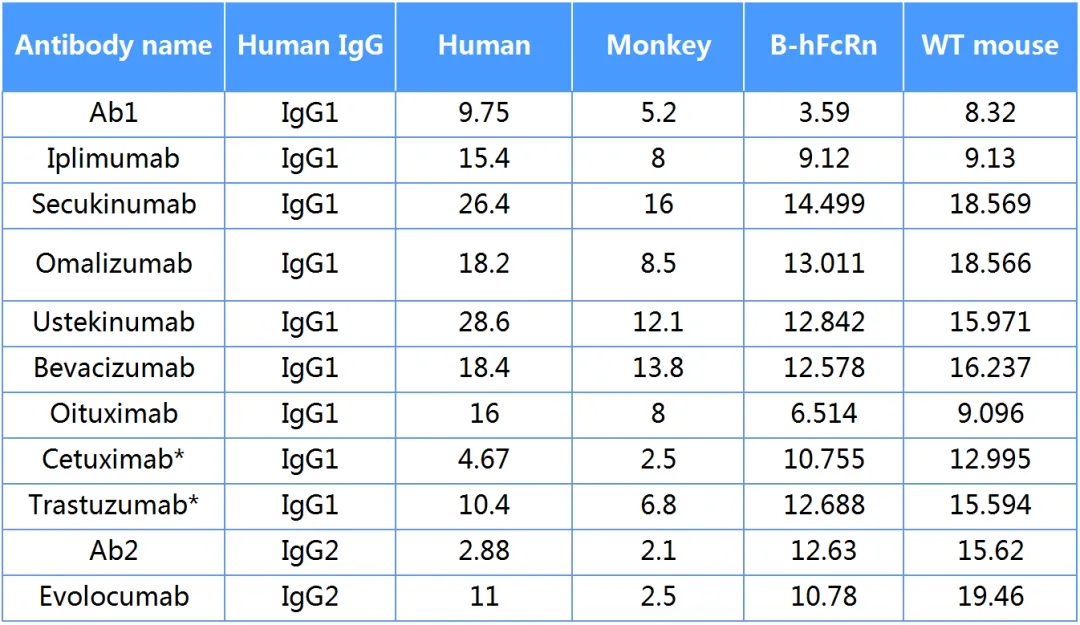
表2: 百奥动物内部验证的部分抗体半衰期数据,基于人体临床,猴,B-FcRn小鼠和野生型小鼠实验。B-FcRn小鼠在不同的抗体亚型,靶点上有广泛的应用潜能。
FcRn与抗体改造
抗体开发科学家会对人源化抗体新药进行针对性的改造策略,以期获得更好的疗效,更长的半衰期和更高的安全性。Fc-FcRn相互作用的设计优化,是调节治疗性IgG抗体药代动力学特征的高效策略之一,可显著提升其临床疗效并改善给药便利性。目前,基于Fc-FcRn结合位点的工程化改造主要应用于三大领域:抗体半衰期延长、IgG清除调控以及抗原清除效率提升。
在Fc改造研究领域,美国Sally Ward教授团队做出了开创性贡献,成功鉴定了Fc结构域中的关键突变组合YTE+KF(M252Y/ S254T/ T256E/ H433K/ N434F)。该突变可显著增强Fc-FcRn结合亲和力,为抗体半衰期延长和清除调控等应用奠定基础。在众多pH依赖性FcRn结合工程Fc变体中,M252Y/S254T/T256E(YTE)和M428L/ N434S(LS)变体是研究最为广泛的,并且已在延长各种治疗性IgG抗体循环半衰期方面获得临床验证。例如,治疗新冠的中和抗体VIR-7831(Sotrovimab)、治疗阵发性睡眠性血红蛋白尿症(PNH)的Ultomiris(Ravulizumab)等都在IgG抗体上引入了LS变体,并获得了美国FDA批准上市。
由于人源抗体Fc片段对于mFcRn和hFcRn受体的识别序列存在明显差异,导致抗体Fc段和Fc段-YTE改造后无法在野生型小鼠的体内药代研究中被区分。而B-hFcRn小鼠模型通过全人源化FcRn受体,能够为早期的抗体优化阶段提供更具参考价值的药代动力学数据支持。
01、改造前后药代动力学数据
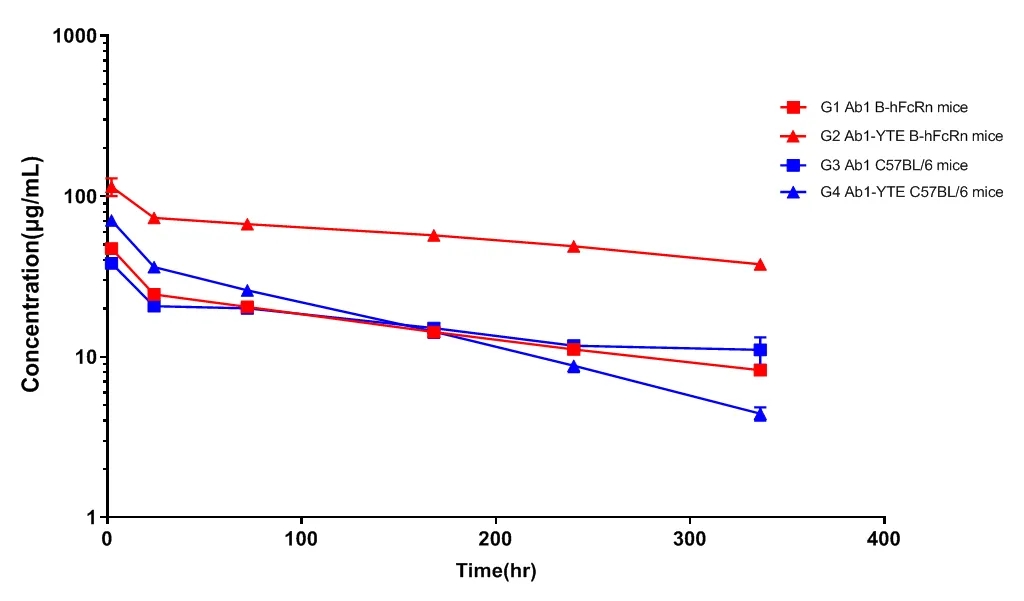
图5:某抗体产品Fc段YTE改造前后在C57BL/6和B-hFcRn小鼠上的药代动力学数据
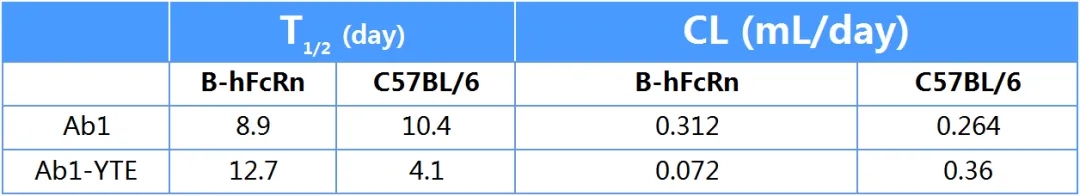
表3:抗体YTE改造前后,在B-hFcRn和C57BL/6小鼠中的药代参数。可见抗体YTE改造后,在B-hFcRn中半衰期对应延长,清除率降低,符合理论预期。但在野生型C57BL/6小鼠中,结果相反:改造后半衰期明显缩短,清除率升高。
上述案例数据表明,针对Fc段改造后抗体的药代动力学评价,使用B-hFcRn小鼠可以提供有效的药代参数,帮助抗体开发科学家明确改造策略,节约抗体早期开发阶段的时间成本;而使用野生型小鼠的药代动力学实验数据可能存在偏差。
抗体药物靶点介导的药物消除
抗体药物靶点介导的药物消除(TMDD)主要用于解释抗体等生物制品的饱和清除机制,抗体一般具有较大的分子质量,较慢的吸收速率,受限的体内分布特性,其清除过程也异于小分子药物。此外,抗体通常具有高亲和力,能特异性结合靶点,这种靶向的结合与解离过程会显著影响药物的体内处置(分布及清除) 。体内靶点数量的限制会造成饱和现象,使药物的 PK 和 PD 行为表现出非线性特征。
通过不同给药剂量下的游离单抗浓度-时间曲线(纵坐标为对数尺度的浓度),可用于阐述单抗暴露量与靶点量之间的相对关系对TMDD途径作用的影响程度。当单抗初始暴露量远小于靶点量时(图6蓝线),TMDD途径远未饱和,药物主要呈现线性药动学特征;当单抗初始暴露量大于靶点量时(图6红线),靶点被饱和,药物-靶点复合物的结合与内化成为主导清除途径,此时清除率随剂量增加而降低,表现为非线性药动学特征;当单抗初始暴露量远高于靶点量时(图6橙线),药物主要通过异化作用消除,再次呈现线性清除机制。在实际应用中,为了获得药物最大疗效(即较高的靶点占有率),往往需使单抗暴露量显著高于靶点量,因此红线和蓝线所代表的情况在临床中较为常见。
01、抗体血药浓度曲线与TMDD的对应关系
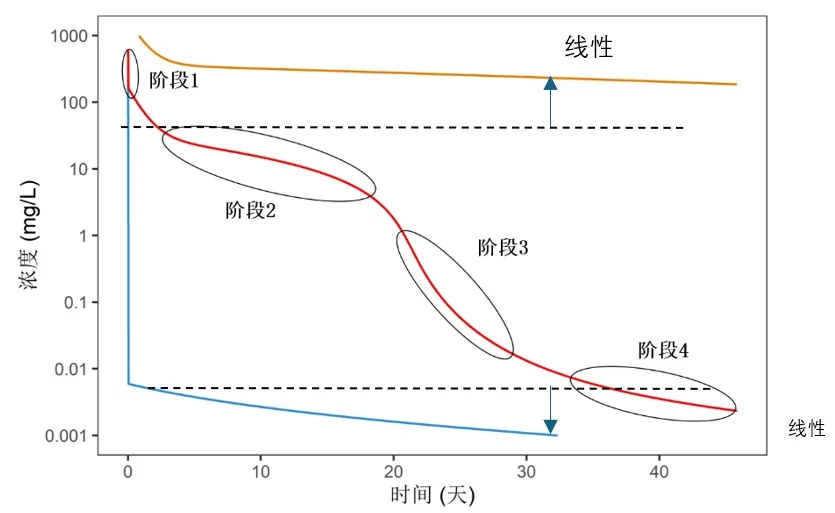
图6:通过不同给药剂量下的游离单抗浓度-时间曲线
完整的TMDD药时曲线包含4个典型阶段:
-
短暂初始期:在高浓度下,药物与靶点以高亲和力快速结合,靶点被完全饱和;
-
表观线性期:一旦靶点被完全饱和,游离单抗主要通过一级过程的异化作用缓慢消除,呈现线性药动学特征;
-
过渡期:药物-靶点复合物以及游离药物被逐渐消除,又有新的靶点生成,靶点的饱和状态降低,TMDD消除途径的影响越来越明显,呈现非线性药动学特征;
-
线性终末期:药物浓度进一步降低,药物与靶点的结合远未达饱和,靶点介导的药物处置和异化作用均为一级消除,因此呈现线性药动学特征。
百奥动物提供hFcRn+对应靶点人源化的多种转基因小鼠品系,可以更好地评价抗体药物的TMDD的药代动力学特点,从而助力转化医学研发。
02、药代动力学
B-hCD40/hFcRn多靶点转基因小鼠用于CD40抗体药物的PK研究数据
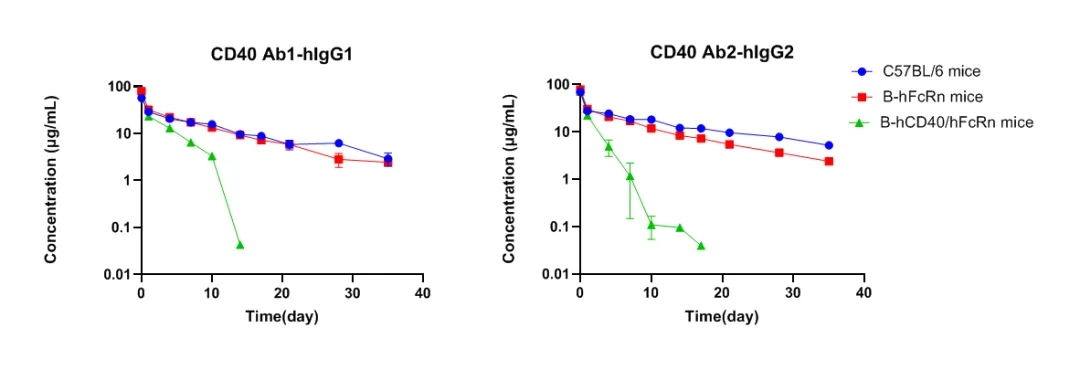
在野生型小鼠中,抗体的暴露水平远高于靶点水平,药物消除为蛋白异化,药代曲线为线性消除。而在B-hCD40/hFcRn双人源化小鼠中PK曲线可见基于靶点介导的药物消除。
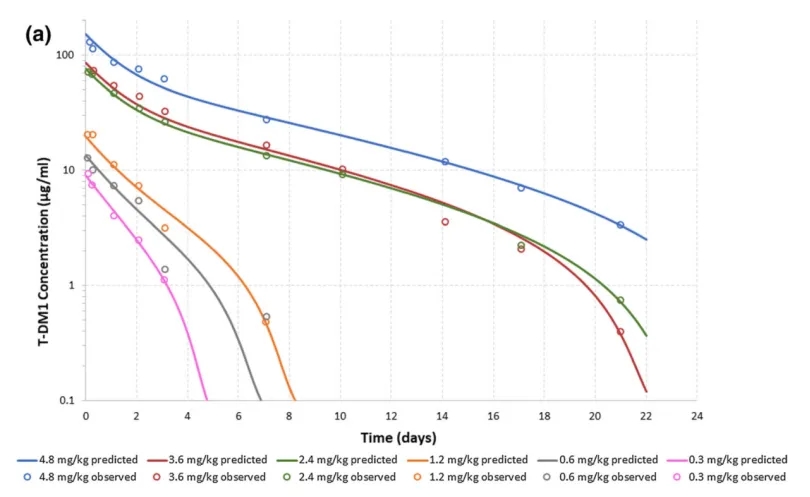
图7:抗体建模模拟与数据观测点[3]
药代模型与临床转化
使用B-hFcRn小鼠进行帕博利珠单抗(肿瘤免疫 PD-1靶点)的PK研究,可成功建立PPK模型。参考文献报道的Tg32 hFcRn 异速缩放公式[4],基于B-hFcRn小鼠的清除率的群体典型值,建立了一个异速缩放模型:
parameterhuman= parametermice *(weighthuman/weightmice)0.9

附图: 部分建模图表
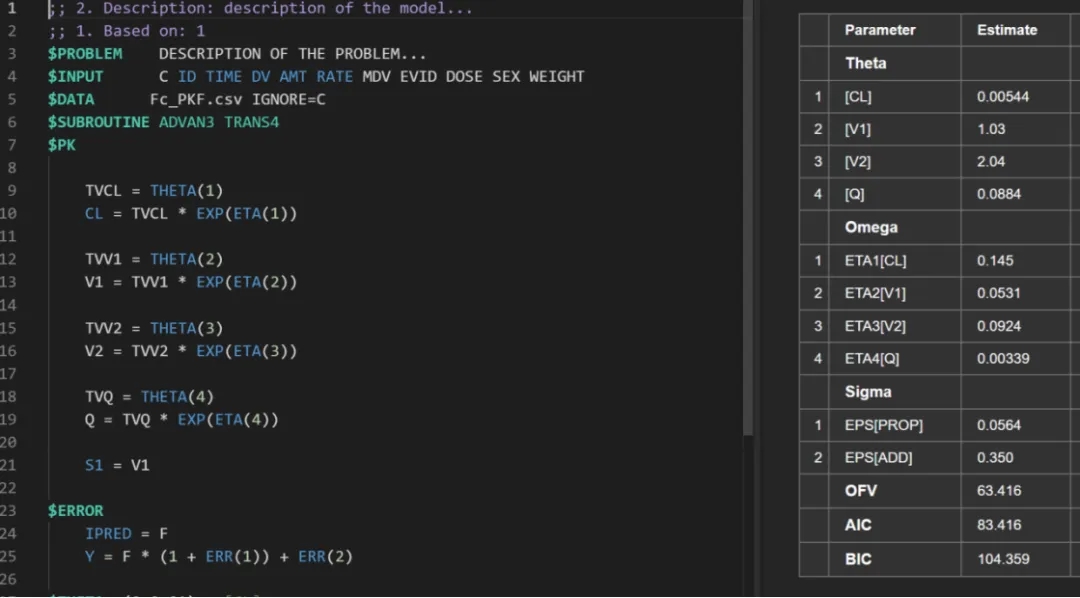
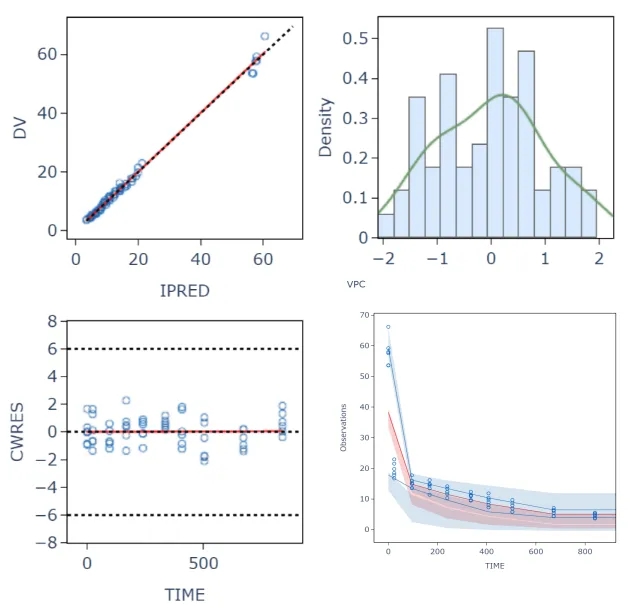
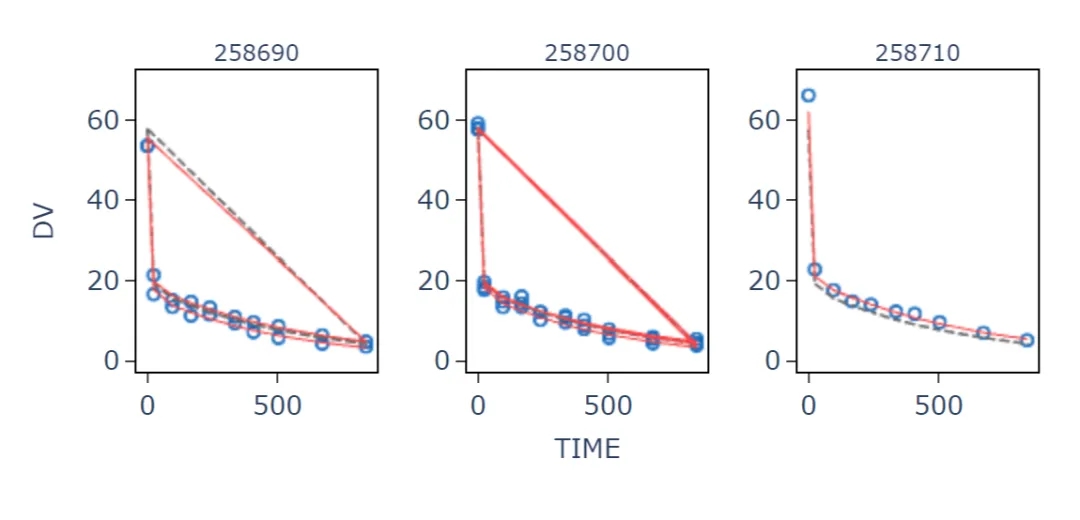
人体体重中位数76.8 kg,CL群体典型值 0.22L/day[5],B-hFcRn小鼠体重取平均体重0.025 kg。根据B -hFcRn小鼠模型数据可以非常精准预测人体CL Vc Q Vp等群体药代动力学参数(CL相对误差为1.68%)。
FcRn对抗体的体内药代动力学过程有非常重要的作用,百奥动物开发的B-hFcRn全人源化小鼠及其对应的多靶点小鼠(及对应药效模型),充分支持抗体药物的早期开发,抗体工程改造评价,建模模拟预测临床人体PK特征,为抗体开发科学家节约宝贵时间成本及提供精准的预测信息。百奥动物团队建立了多靶点B-hFcRn转基因小鼠资源库,小鼠PK实验,检测分析和建模平台,高质量服务和深厚的数据经验积累,助力广大抗体新药研发企业。
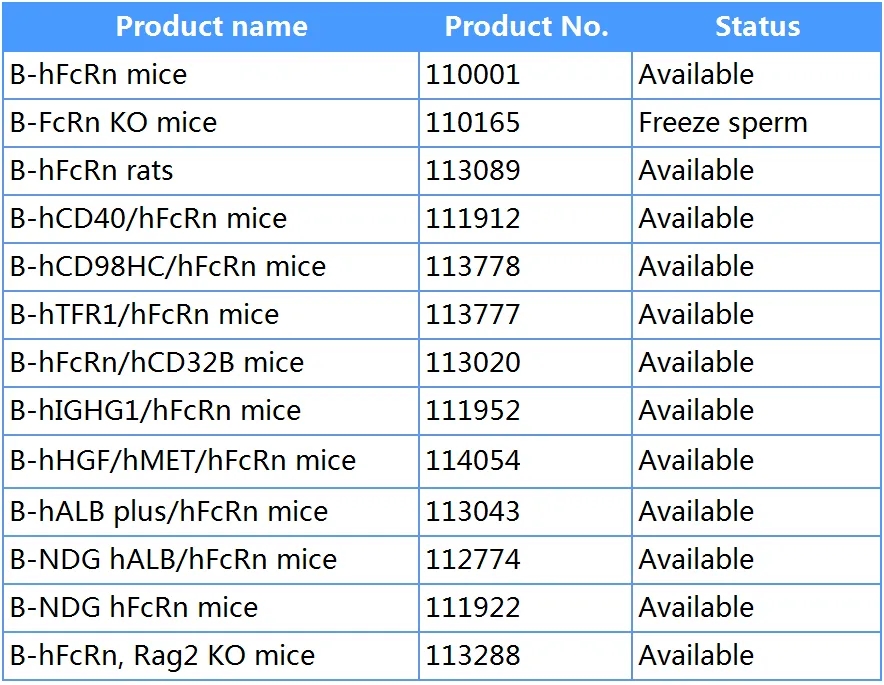
百奥动物产品列表
参考文献:
1、Roopenian DC, Akilesh S. FcRn: the neonatal Fc receptor comes of age. Nat Rev Immunol 2007 Sep;7(9):715-25.
2、ashi S, Nagai Y, Ogata H, Oikawa M, Fukase K, Kusumoto S, Kawasaki K, Nishijima M, Hayashi S, Kimoto M, Miyake K. Int Immunol 2001 Dec;13(12):1595-9.
3、Betts A, Clark T, Jasper P, Tolsma J, van der Graaf PH, Graziani EI, Rosfjord E, Sung M, Ma D, Barletta F. Use of translational modeling and simulation for quantitative comparison of PF-06804103, a new generation HER2 ADC, with Trastuzumab-DM1. J Pharmacokinet Pharmacodyn 2020 July;47:513-526.
4、Betts A, Keunecke A, van Steeg TJ, van der Graaf PH,Avery LB, Jones H, Berkhout J. Linear pharmacokinetic parameters for monoclonal antibodies are similar within a species and across different pharmacological targets:A comparison between human, cynomolgus monkey and hFcRn Tg32 transgenic mouse using a population-modeling approach. MABS 2018 May;10(5):751-764.
5、Ahamadi M, Freshwater T,Prohn M, Li CH, de Alwis DP, de Greef, Elassaiss-Schaap J, Kondic A, Stone JA. Model-based characterization of the pharmacokinetics of Pembrolizumab: A humanized anti-PD-1 monoclonal antibody in advanced solid tumors. CPT Pharmacometrics Syst Pharmacol 2016 Nov;6(1):49-57.
FcRn(新生儿Fc受体)最初在新生大鼠肠道中被发现,其功能是将母乳中的IgG抗体通过肠上皮细胞转运至新生儿血液,使新生儿获得被动免疫。后续研究发现,人类胎盘中的合体滋养层同样表达FcRn,能够将母体循环中的IgG转运至胎儿毛细血管,实现母体抗体在产前向胎儿的传递。
FcRn的免疫功能主要依赖于其pH依赖性的配体结合特性,具体表现为两种机制:被动免疫功能通过回收和转胞吞作用,拯救单体IgG免于降解并促进其跨细胞转运;而主动免疫功能则通过介导IgG-免疫复合物的参与,激活并增强先天性和适应性免疫应答。在血管内皮细胞中,FcRn能选择性识别内吞的IgG,并将其重新释放至血液循环,显著延长IgG的半衰期。
这种独特的pH依赖性结合机制表现为:在酸性环境(pH 6.0-6.5)如内体中,FcRn与IgG紧密结合;当转运至微碱性(pH 7.35-7.45)的细胞外环境时,二者迅速解离,从而完成IgG的“回收”过程。
此外,靶向FcRn的免疫治疗也在临床中展现出广阔前景。通关清除致病性IgG以减轻神经肌肉传递的干扰,FcRn抑制剂已被用于治疗重症肌无力。目前已有2 款FcRn抑制剂获得FDA批准上市,分别是罗泽利昔珠单抗和艾加莫德。
图1:FcRn介导的IgG循环保护作用[1]
抗体药物的PK受多种因素影响,包括电荷、类型、分子量、亲和力、pH依赖的FcRn结合亲和力、靶点介导的药物消除机制,糖基化以及抗药抗体等。文献报道,人源抗体与小鼠mFcRn在体内的亲和力一般较人类hFcRn更高,因此IgG在小鼠体内表现出更长的半衰期。这种差异可能在新药开发早期阶段的非临床PK研究中影响模型的转化效果,从而在预测人体PK时产生一定的误差。
图2:人鼠FcRn结合力差异[2]
百奥动物利用自身稳定可靠的基因编辑技术,对小鼠FcRn进行全人源化,与人体PK特点更为接近,避免上述mFcRn对人源IgG 抗体的影响。目前B-hFcRn(H/H)小鼠品系助力抗体新药PK研发并积累了丰富的成功案例数据。
图3:B-hFcRn小鼠的RT-PCR和WB水平验证
图4:Rituximab和Ustekinumab抗体在C57BL和B-hFcRn小鼠中的血药浓度曲线

表1: 市售Rituximab和Ustekinumab抗体的半衰期。B-hFcRn小鼠中的上市抗体半衰期较野生型小鼠明显缩短(Rituximab 6.51 vs 9.10 day;Ustekinumab 12.84 vs 15.97 day),与猴的半衰期数据更为接近,临床预测价值更高(内部数据)。
表2: 百奥动物内部验证的部分抗体半衰期数据,基于人体临床,猴,B-FcRn小鼠和野生型小鼠实验。B-FcRn小鼠在不同的抗体亚型,靶点上有广泛的应用潜能。
抗体开发科学家会对人源化抗体新药进行针对性的改造策略,以期获得更好的疗效,更长的半衰期和更高的安全性。Fc-FcRn相互作用的设计优化,是调节治疗性IgG抗体药代动力学特征的高效策略之一,可显著提升其临床疗效并改善给药便利性。目前,基于Fc-FcRn结合位点的工程化改造主要应用于三大领域:抗体半衰期延长、IgG清除调控以及抗原清除效率提升。
在Fc改造研究领域,美国Sally Ward教授团队做出了开创性贡献,成功鉴定了Fc结构域中的关键突变组合YTE+KF(M252Y/ S254T/ T256E/ H433K/ N434F)。该突变可显著增强Fc-FcRn结合亲和力,为抗体半衰期延长和清除调控等应用奠定基础。在众多pH依赖性FcRn结合工程Fc变体中,M252Y/S254T/T256E(YTE)和M428L/ N434S(LS)变体是研究最为广泛的,并且已在延长各种治疗性IgG抗体循环半衰期方面获得临床验证。例如,治疗新冠的中和抗体VIR-7831(Sotrovimab)、治疗阵发性睡眠性血红蛋白尿症(PNH)的Ultomiris(Ravulizumab)等都在IgG抗体上引入了LS变体,并获得了美国FDA批准上市。
由于人源抗体Fc片段对于mFcRn和hFcRn受体的识别序列存在明显差异,导致抗体Fc段和Fc段-YTE改造后无法在野生型小鼠的体内药代研究中被区分。而B-hFcRn小鼠模型通过全人源化FcRn受体,能够为早期的抗体优化阶段提供更具参考价值的药代动力学数据支持。
图5:某抗体产品Fc段YTE改造前后在C57BL/6和B-hFcRn小鼠上的药代动力学数据
表3:抗体YTE改造前后,在B-hFcRn和C57BL/6小鼠中的药代参数。可见抗体YTE改造后,在B-hFcRn中半衰期对应延长,清除率降低,符合理论预期。但在野生型C57BL/6小鼠中,结果相反:改造后半衰期明显缩短,清除率升高。
上述案例数据表明,针对Fc段改造后抗体的药代动力学评价,使用B-hFcRn小鼠可以提供有效的药代参数,帮助抗体开发科学家明确改造策略,节约抗体早期开发阶段的时间成本;而使用野生型小鼠的药代动力学实验数据可能存在偏差。
抗体药物靶点介导的药物消除(TMDD)主要用于解释抗体等生物制品的饱和清除机制,抗体一般具有较大的分子质量,较慢的吸收速率,受限的体内分布特性,其清除过程也异于小分子药物。此外,抗体通常具有高亲和力,能特异性结合靶点,这种靶向的结合与解离过程会显著影响药物的体内处置(分布及清除) 。体内靶点数量的限制会造成饱和现象,使药物的 PK 和 PD 行为表现出非线性特征。
通过不同给药剂量下的游离单抗浓度-时间曲线(纵坐标为对数尺度的浓度),可用于阐述单抗暴露量与靶点量之间的相对关系对TMDD途径作用的影响程度。当单抗初始暴露量远小于靶点量时(图6蓝线),TMDD途径远未饱和,药物主要呈现线性药动学特征;当单抗初始暴露量大于靶点量时(图6红线),靶点被饱和,药物-靶点复合物的结合与内化成为主导清除途径,此时清除率随剂量增加而降低,表现为非线性药动学特征;当单抗初始暴露量远高于靶点量时(图6橙线),药物主要通过异化作用消除,再次呈现线性清除机制。在实际应用中,为了获得药物最大疗效(即较高的靶点占有率),往往需使单抗暴露量显著高于靶点量,因此红线和蓝线所代表的情况在临床中较为常见。
完整的TMDD药时曲线包含4个典型阶段:
短暂初始期:在高浓度下,药物与靶点以高亲和力快速结合,靶点被完全饱和;
表观线性期:一旦靶点被完全饱和,游离单抗主要通过一级过程的异化作用缓慢消除,呈现线性药动学特征;
过渡期:药物-靶点复合物以及游离药物被逐渐消除,又有新的靶点生成,靶点的饱和状态降低,TMDD消除途径的影响越来越明显,呈现非线性药动学特征;
线性终末期:药物浓度进一步降低,药物与靶点的结合远未达饱和,靶点介导的药物处置和异化作用均为一级消除,因此呈现线性药动学特征。
百奥动物提供hFcRn+对应靶点人源化的多种转基因小鼠品系,可以更好地评价抗体药物的TMDD的药代动力学特点,从而助力转化医学研发。
B-hCD40/hFcRn多靶点转基因小鼠用于CD40抗体药物的PK研究数据
在野生型小鼠中,抗体的暴露水平远高于靶点水平,药物消除为蛋白异化,药代曲线为线性消除。而在B-hCD40/hFcRn双人源化小鼠中PK曲线可见基于靶点介导的药物消除。

图7:抗体建模模拟与数据观测点[3]
使用B-hFcRn小鼠进行帕博利珠单抗(肿瘤免疫 PD-1靶点)的PK研究,可成功建立PPK模型。参考文献报道的Tg32 hFcRn 异速缩放公式[4],基于B-hFcRn小鼠的清除率的群体典型值,建立了一个异速缩放模型:
parameterhuman= parametermice *(weighthuman/weightmice)0.9
附图: 部分建模图表

人体体重中位数76.8 kg,CL群体典型值 0.22L/day[5],B-hFcRn小鼠体重取平均体重0.025 kg。根据B -hFcRn小鼠模型数据可以非常精准预测人体CL Vc Q Vp等群体药代动力学参数(CL相对误差为1.68%)。
FcRn对抗体的体内药代动力学过程有非常重要的作用,百奥动物开发的B-hFcRn全人源化小鼠及其对应的多靶点小鼠(及对应药效模型),充分支持抗体药物的早期开发,抗体工程改造评价,建模模拟预测临床人体PK特征,为抗体开发科学家节约宝贵时间成本及提供精准的预测信息。百奥动物团队建立了多靶点B-hFcRn转基因小鼠资源库,小鼠PK实验,检测分析和建模平台,高质量服务和深厚的数据经验积累,助力广大抗体新药研发企业。
参考文献:
1、Roopenian DC, Akilesh S. FcRn: the neonatal Fc receptor comes of age. Nat Rev Immunol 2007 Sep;7(9):715-25.
2、ashi S, Nagai Y, Ogata H, Oikawa M, Fukase K, Kusumoto S, Kawasaki K, Nishijima M, Hayashi S, Kimoto M, Miyake K. Int Immunol 2001 Dec;13(12):1595-9.
3、Betts A, Clark T, Jasper P, Tolsma J, van der Graaf PH, Graziani EI, Rosfjord E, Sung M, Ma D, Barletta F. Use of translational modeling and simulation for quantitative comparison of PF-06804103, a new generation HER2 ADC, with Trastuzumab-DM1. J Pharmacokinet Pharmacodyn 2020 July;47:513-526.
4、Betts A, Keunecke A, van Steeg TJ, van der Graaf PH,Avery LB, Jones H, Berkhout J. Linear pharmacokinetic parameters for monoclonal antibodies are similar within a species and across different pharmacological targets:A comparison between human, cynomolgus monkey and hFcRn Tg32 transgenic mouse using a population-modeling approach. MABS 2018 May;10(5):751-764.
5、Ahamadi M, Freshwater T,Prohn M, Li CH, de Alwis DP, de Greef, Elassaiss-Schaap J, Kondic A, Stone JA. Model-based characterization of the pharmacokinetics of Pembrolizumab: A humanized anti-PD-1 monoclonal antibody in advanced solid tumors. CPT Pharmacometrics Syst Pharmacol 2016 Nov;6(1):49-57.















